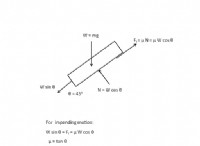
Γιατί το υδρογόνο ξεχωρίζει γιατί είναι από τον εαυτό;
1. Μοναδική ηλεκτρονική δομή:Το υδρογόνο έχει μια μοναδική ηλεκτρονική δομή σε σύγκριση με άλλα στοιχεία. Έχει μόνο ένα ηλεκτρόνιο που περιστρέφεται γύρω από τον πυρήνα του, καθιστώντας το το απλούστερο άτομο. Αυτό το ενιαίο ηλεκτρόνιο μπορεί εύκολα να χαθεί ή να μοιραστεί, δίνοντας υδρογόνο τις χαρακτηριστικές χημικές του ιδιότητες.
2. Θέση στον περιοδικό πίνακα:Το υδρογόνο τοποθετείται στην κορυφή του περιοδικού πίνακα, στην ομάδα 1 (αλκαλικά μέταλλα). Ωστόσο, διαφέρει σημαντικά από άλλα αλκαλικά μέταλλα. Ενώ τα αλκαλικά μέταλλα συνήθως χάνουν το ηλεκτρόνιο ενιαίο σθένος τους για να σχηματίσουν θετικά ιόντα, το υδρογόνο μπορεί να χάσει και τα δύο του ηλεκτρονίου για να γίνει ένα θετικά φορτισμένο ιόν (Η+) ή να κερδίσει ένα ηλεκτρόνιο για να γίνει ένα αρνητικά φορτισμένο ιόν (Η-).
3. Διπλή φύση:Το υδρογόνο παρουσιάζει διπλή φύση, συμπεριφέροντας τόσο ως μέταλλο όσο και ως μη μέταλλο. Μπορεί να σχηματίσει ιοντικές ενώσεις όπως μέταλλα (π.χ. υδρίδιο νατρίου, ΝΑΑ) και ομοιοπολικές ενώσεις όπως μη μέταλλα (π.χ. υδρογόνο χλωριούχο, ΗΟΙ). Αυτή η ευελιξία καθιστά το υδρογόνο μοναδικό και του επιτρέπει να σχηματίζει ένα ευρύ φάσμα ενώσεων.
4. Αφθονία:Το υδρογόνο είναι το πιο άφθονο στοιχείο στο σύμπαν και αποτελεί ένα σημαντικό μέρος της ατμόσφαιρας, του νερού και των οργανικών μορίων της Γης. Ο επιπολασμός και η υψηλή αντιδραστικότητα συμβάλλουν στον ζωτικό της ρόλο σε διάφορες χημικές διεργασίες.
5. Ισοτόπια:Το υδρογόνο έχει τρία φυσικά ισότοπα:πρωτόνιο (¹H), δευτέριο (²h, επίσης γνωστό ως βαρύ υδρογόνο) και τρίνιο (³H). Αυτά τα ισότοπα έχουν διαφορετικούς αριθμούς νετρονίων στους πυρήνες τους και παρουσιάζουν ελαφρώς διαφορετικές φυσικές και χημικές ιδιότητες.
Λόγω αυτών των ξεχωριστών χαρακτηριστικών, το υδρογόνο θεωρείται συχνά ειδική περίπτωση και τοποθετείται ξεχωριστά από άλλα στοιχεία στον περιοδικό πίνακα. Οι μοναδικές του ιδιότητες καθιστούν απαραίτητη για πολλές χημικές αντιδράσεις και διαδραματίζουν κεντρικό ρόλο σε πολλούς τομείς της επιστήμης, συμπεριλαμβανομένης της χημείας, της φυσικής και της βιολογίας.