Γιατί το νερό καταστρέφει τα ηλεκτρονικά, αλλά το αλκοόλ συχνά όχι;
Το νερό άγει τον ηλεκτρισμό καλύτερα από το αλκοόλ και έτσι προκαλεί βραχυκύκλωμα. Επίσης, το νερό διαβρώνει τα μέταλλα ενώ οι αλκοόλες όχι. Το νερό χρειάζεται περισσότερο χρόνο για να εξατμιστεί από τις αλκοόλες.
Θυμάστε ότι μια φορά που απολαμβάνατε άρθρα του ScienceABC στο smartphone σας με ένα φλιτζάνι τσάι για πνευματική διέγερση, όταν το τηλέφωνο γλίστρησε και έπεσε στο φλιτζάνι, καταστρέφοντας ουσιαστικά και τα δύο;
Η συμβατική σοφία υπαγορεύει ότι τα υγρά και τα ηλεκτρονικά δεν πάνε μαζί, αλλά ξέρετε τι ακριβώς έκανε το τσάι στο τηλέφωνό σας; Επίσης, αν το αλκοόλ είχε αντικαταστήσει αυτό το τσάι, το αποτέλεσμα θα ήταν το ίδιο;
Η απάντηση εξηγείται από τις διαφορές στις χημικές και φυσικές ιδιότητες του νερού και του αλκοόλ.
Χημεία του νερού
Ένα μόριο νερού έχει δύο άτομα υδρογόνου συνδεδεμένα με ένα άτομο οξυγόνου, που συμβολίζεται με τον χημικό τύπο H2O. Το οξυγόνο και το υδρογόνο σχηματίζουν έναν δεσμό μοιράζοντας ένα ζεύγος ηλεκτρονίων, με κάθε ηλεκτρόνιο του ζεύγους να δίνεται από Υδρογόνο και Οξυγόνο, αντίστοιχα. Αυτό ονομάζεται ομοιοπολικός δεσμός. Μια συνέπεια της κοινής χρήσης ηλεκτρονίων είναι ότι δεν υπάρχουν ελεύθερα ηλεκτρόνια που να μεταφέρουν ηλεκτρισμό. Στην πραγματικότητα, το καθαρό απιονισμένο νερό δεν μεταφέρει ηλεκτρισμό.
Το οξυγόνο έχει μια εκπληκτική ιδιότητα να προσελκύει ηλεκτρόνια προς τον εαυτό του περισσότερο από το Υδρογόνο (ηλεκτραρνητικότητα ). Σε ένα μόριο νερού, το ζεύγος ηλεκτρονίων συνδέεται πιο στενά με το Οξυγόνο και το Υδρογόνο. Έτσι, ένα μερικό αρνητικό φορτίο αναπτύσσεται στα άτομα Ο και ένα μερικό θετικό φορτίο στα άτομα Η. Η γεωμετρία των μορίων του νερού είναι τέτοια ώστε να υπάρχει διαχωρισμός φορτίων (τα κέντρα θετικών και αρνητικών φορτίων δεν συμπίπτουν).
Ένα μόριο μπορεί να έχει στοιχεία με διαφορετική ηλεκτραρνητικότητα και ωστόσο να είναι μη πολικό, όπως το μεθάνιο, το CH4. Αυτό κάνει το νερό ένα πολικό (που έχει πόλους αντίθετων φορτίων) μόριο. Εξαιτίας αυτού, ορυκτά όπως Ca2+, Mg2+, Na+, Cl– κ.λπ. διαλύονται (ο αρνητικός πόλος του μορίου του νερού έλκει τα θετικά φορτισμένα ορυκτά ιόντα και αντίστροφα). Αυτά τα ιόντα μπορούν να μεταφέρουν ηλεκτρισμό παρουσία δυνητικής διαφοράς .
Επίσης, ο διαμοριακός δεσμός είναι ισχυρός στο νερό λόγω του διαμοριακού δεσμού υδρογόνου. Αυτός είναι ο λόγος για το υψηλό σημείο βρασμού του νερού, σε σύγκριση με τις αλκοόλες.
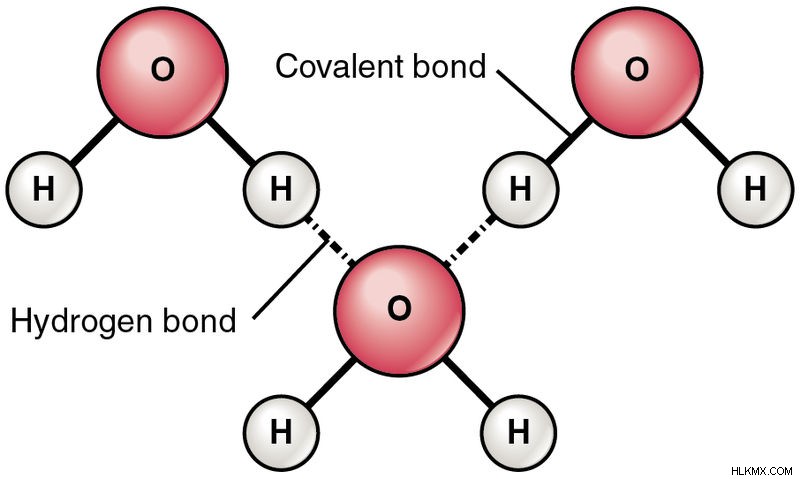
Δομικός τύπος μορίων νερού που δείχνει τους ομοιοπολικούς δεσμούς και τους δεσμούς υδρογόνου (Photo Credit :OpenStax College
/Wikimedia Commons)
Χημεία του αλκοόλ
Στην κοινή γλώσσα, το αλκοόλ αναφέρεται είτε σε ποτό είτε σε υγρό για ιατρικούς σκοπούς. Ωστόσο, στην επιστήμη, το αλκοόλ δεν είναι ένα μεμονωμένο υγρό, αλλά μια κατηγορία οργανικών (δηλαδή, που περιέχουν άνθρακα) ενώσεων που έχουν τη λειτουργική ομάδα (-ΟΗ). Μια λειτουργική ομάδα είναι μια συλλογή ατόμων, έτσι ώστε ορισμένες διακριτικές ιδιότητες να συνδέονται με την οργανική ένωση που συνδέεται με αυτήν.
Όπως συνέβη και με το νερό, οι δεσμοί που σχηματίζονται μεταξύ των στοιχείων είναι ομοιοπολικοί δεσμοί (κοινή χρήση ηλεκτρονίων). Αυτό μεταφράζεται σε έλλειψη ελεύθερων ηλεκτρονίων και ιόντων για την αγωγή του ηλεκτρισμού. Έτσι, το καθαρό οινόπνευμα είναι επίσης μονωτικό.
Η διάλυση ανόργανων ιόντων στην αλκοόλη γίνεται πιο δύσκολη από τη διάλυσή τους στο νερό, καθώς υπάρχει στερικό εμπόδιο (δυσκολία υποδοχής νέων ειδών λόγω απώθησης από υπάρχοντα είδη) μεταξύ της αλυσίδας άνθρακα και των ορυκτών ιόντων. το μέγεθος του φορτίου είναι επίσης μικρότερο στις αλκοόλες.
Δεδομένου ότι το άκρως ηλεκτραρνητικό Ο είναι προσκολλημένο στο ένα άκρο, έλκει ζεύγη ηλεκτρονίων προς τον εαυτό του, αποκτώντας ένα μερικό αρνητικό φορτίο και δίνοντας ένα μερικό θετικό φορτίο σε άλλα άτομα. Οι αλκοόλες μπορούν να απεικονιστούν ότι έχουν ένα πολικό άκρο (-OH) και ένα μη πολικό άκρο (αλυσίδα άνθρακα). Αυτό καθιστά το αλκοόλ μια αμφιφιλική ένωση (κατάλληλη για σύνδεση τόσο με πολικές όσο και με μη πολικές ενώσεις), η οποία έχει εφαρμογές τόσο στον καθαρισμό όσο και στην απολύμανση.
Επίσης, η διαμοριακή έλξη στις αλκοόλες είναι πιο αδύναμη από ό,τι στο νερό (στερικό εμπόδιο που προκαλείται από την παρουσία ογκώδους ανθρακικής αλυσίδας). Έτσι, είναι πιο εύκολο να εξατμιστεί το αλκοόλ παρά το νερό .
Οι ράβδοι υποδηλώνουν αλυσίδες άνθρακα και το -OH είναι η λειτουργική ομάδα (Φωτογραφία:Peter Hermes Furian/Shutterstock)
Επίδραση του νερού στα ηλεκτρονικά
Οι συνέπειες της επαφής του νερού με τα ηλεκτρονικά μπορούν να χωριστούν σε δύο μέρη, δηλαδή βραχυπρόθεσμες και μακροπρόθεσμες επιπτώσεις.
Δεδομένου ότι το νερό περιέχει διαλυμένα ορυκτά ιόντα, είναι ικανό να μεταφέρει ηλεκτρισμό. Όταν μια ενεργοποιημένη συσκευή έρχεται σε επαφή με νερό, πολλαπλοί ακροδέκτες στο εσωτερικό της συσκευής έρχονται σε επαφή με τον ίδιο αγωγό, δηλαδή με νερό. Δημιουργείται μια εναλλακτική διαδρομή για τη ροή ρεύματος και η ηλεκτρική ενέργεια αρχίζει να ρέει προς τις κατευθύνσεις όπου δεν θα έπρεπε. Αυτό ονομάζεται βραχυκύκλωμα. Κατά τη διάρκεια ενός βραχυκυκλώματος, μια τεράστια ποσότητα ρεύματος λαμβάνει χώρα σε σύντομο χρονικό διάστημα, με αποτέλεσμα την υπερβολική θέρμανση και, στις χειρότερες περιπτώσεις, τη φωτιά!
Δεδομένου ότι οι περισσότερες συσκευές χρησιμοποιούν μπαταρίες DC ως πηγή ενέργειας, το νερό που έρχεται σε επαφή με την άνοδο και την κάθοδο της μπαταρίας θα οδηγούσε σε ηλεκτρόλυση με την έκλυση εύφλεκτων αερίων H2 και O2.
Το νερό περιέχει επίσης μόρια διαλυμένου οξυγόνου (Ο2). Όλα τα ηλεκτρονικά περιέχουν PCB (πλακέτες τυπωμένων κυκλωμάτων). Τα PCB έχουν μέταλλα όπως ο χαλκός, ο χρυσός και το παλλάδιο ως αγωγοί. Όταν εκτίθεται στο νερό, εμφανίζεται μια αντίδραση οξειδοαναγωγής όπου το μέταλλο χάνει ηλεκτρόνια και σχηματίζει ένα στρώμα μεταλλικού οξειδίου. Υπερωρίες, αυτό έχει ως αποτέλεσμα τη μείωση του όγκου του αγώγιμου μετάλλου στον ακροδέκτη (αποσύνθεση). Σε ακραίες περιπτώσεις, το μέταλλο γίνεται δομικά αδύναμο και σπάει.
Οι οθόνες LED/LCD περιέχουν ένα πλαίσιο οπίσθιου φωτισμού που παρέχει φωτισμό. Όταν το νερό εισέρχεται στον πίνακα οπίσθιου φωτισμού, εμφανίζεται η ακατάλληλη διάθλαση του φωτός και η προκύπτουσα οθόνη παραμορφώνεται (θολή εμφάνιση, μαύρα στίγματα, κ.λπ.).

Ημιαγωγοί που έχουν υποστεί ζημιά από διάβρωση (Φωτογραφία :Binarysequence/Wikimedia commons)
Επιπλέον, τα μόρια του νερού μπορούν να μπλοκάρουν τα ηχεία, με αποτέλεσμα τη σίγαση της εξόδου.
Επίδραση του αλκοόλ στα ηλεκτρονικά
Οι αλκοόλες δεν περιέχουν διαλυμένες ιοντικές ακαθαρσίες σε τόσο υψηλές συγκεντρώσεις όσο αυτές που βρίσκονται στο νερό. Όταν το αλκοόλ έρχεται σε επαφή με τα ηλεκτρονικά, η έλλειψη ελεύθερων φορτισμένων ειδών (ιόντα και ελεύθερα ηλεκτρόνια) δεν έχει καμία επίδραση στην αγωγιμότητα. Επομένως, δεν υπάρχει βραχυκύκλωμα.
Δεδομένου ότι το αλκοόλ εξατμίζεται γρηγορότερα από το νερό, εξαλείφεται η πιθανότητα να παραμείνει το αλκοόλ αρκετά για να προκαλέσει ζημιά στα ηλεκτρονικά εξαρτήματα. Έτσι, μειώνεται η πιθανότητα να καταστραφούν η οθόνη και τα ηχεία.
Επιπλέον, δεδομένου ότι το αλκοόλ μπορεί να συνδεθεί τόσο με πολικές όσο και με μη πολικές ενώσεις, το αλκοόλ συνδέεται με μεμβράνες λιπαρών κυττάρων λιπόφιλων μικροβίων και επίσης μετουσιώνει τις πρωτεΐνες στα μικρόβια, σκοτώνοντάς τα αποτελεσματικά. Έτσι, οι αλκοόλες (ειδικά η ισοπροπυλική αλκοόλη, IPA) χρησιμοποιούνται συχνά ως καθαριστικά.

Η ισοπροπυλική αλκοόλη είναι ένα ευρέως χρησιμοποιούμενο καθαριστικό (Photo Credit :twenty20)
Όταν τα αλκοολάκια παίζουν Spoilsport
Υπάρχουν περιπτώσεις, ωστόσο, οι αλκοόλες να καταστρέφουν τα ηλεκτρονικά. Το σημείο ανάφλεξης (χαμηλότερη θερμοκρασία στην οποία η ένωση σχηματίζει ατμούς που είναι εύφλεκτοι παρουσία μιας πηγής ανάφλεξης όπως το οξυγόνο) των αλκοολών καθορίζει τον κίνδυνο αναφλεξιμότητας. Εάν η θερμοκρασία της συσκευής ανέβει πάνω από το σημείο ανάφλεξης, τότε η επαφή του αλκοόλ μπορεί να είναι αρκετά δυσάρεστη (η αλκοόλη σχηματίζει ατμούς που μπορούν να αναφλεγούν). Επομένως, οι αλκοόλες θα πρέπει να χρησιμοποιούνται μόνο όταν η συσκευή είναι απενεργοποιημένη και κρύα.
Εάν το αλκοόλ έρθει σε επαφή τόσο με την άνοδο όσο και με την κάθοδο της μπαταρίας, τότε μπορεί να ηλεκτρολυθεί, εκλύοντας αέριο Η2, το οποίο είναι εύφλεκτο σε συγκεντρώσεις ακόμη και 4% (v/v) στον αέρα.
Οι αλκοόλες χαμηλού μοριακού βάρους όπως η αιθανόλη και η ισοπροπυλική αλκοόλη (IPA) μπορούν να διαλύσουν πολύ μικρές ποσότητες ιοντικών ακαθαρσιών. Εάν υπάρχει επαρκής ποσότητα αλκοόλης (π.χ. βύθιση της συσκευής σε λουτρό αλκοόλης), τότε μπορεί να προκύψει βραχυκύκλωμα.
Μια τελευταία λέξη
Η παραπάνω συζήτηση περιστράφηκε κυρίως γύρω από το πόσιμο νερό και την αλκοόλη χαμηλού μοριακού βάρους (αιθανόλη, ισοπροπυλική αλκοόλη κ.λπ.). Το καθαρό νερό και το καθαρό αλκοόλ σπάνια βλάπτουν τα ηλεκτρονικά, αλλά οι διαλυμένες ακαθαρσίες και οι διαμοριακοί δεσμοί είναι οι κύριοι ένοχοι όταν τα πράγματα πάνε στραβά! Βασικά, δεδομένου ότι το νερό μπορεί να διαλύσει περισσότερες ακαθαρσίες και να εξατμιστεί πιο αργά από τις αλκοόλες, τείνει να καταστρέφει τα ηλεκτρονικά πιο εύκολα από τις αλκοόλες.




