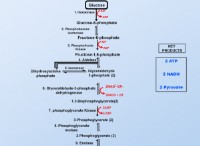
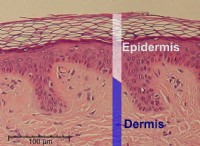
Πώς συμβάλλει ένα μοναδικό ζευγάρι μοριακό σχήμα;
1. Απομάκρυνση: Τα ζεύγη ηλεκτρονίων που βρίσκονται πιο κοντά στο κεντρικό άτομο από τα ζεύγη συγκόλλησης. Αυτό έχει ως αποτέλεσμα ισχυρότερες απωθητικές δυνάμεις μεταξύ των μοναχικών ζευγών και των ζευγών συγκόλλησης.
2. Γεωμετρία τομέα ηλεκτρονίων: Μόνο ζεύγη και ζεύγη συγκόλλησης καταλαμβάνουν περιοχές του χώρου που ονομάζονται τομείς ηλεκτρονίων. Η γεωμετρία αυτών των τομέων επηρεάζεται από τον αριθμό των τομέων ηλεκτρονίων γύρω από το κεντρικό άτομο.
3. Μοριακό σχήμα: Το πραγματικό σχήμα του μορίου καθορίζεται από τη διάταξη των ατόμων, η οποία επηρεάζεται από την απόρριψη μεταξύ των τομέων ηλεκτρονίων. Τα ζεύγη Lone "πιέζουν" τα ζεύγη συγκόλλησης περαιτέρω, οδηγώντας σε διαφορετικό σχήμα σε σύγκριση με ένα μόριο με μόνο ζεύγη συγκόλλησης.
Παράδειγμα:
* νερό (h₂o): Το οξυγόνο έχει δύο μοναχικά ζεύγη και δύο ζεύγη συγκόλλησης. Η γεωμετρία τομέα ηλεκτρονίων είναι τετραεδρική (τέσσερις τομείς ηλεκτρονίων). Ωστόσο, τα μοναχικά ζεύγη ασκούν μεγαλύτερη απόρριψη στα ζεύγη συγκόλλησης, με αποτέλεσμα ένα λυγισμένο σχήμα με γωνία δεσμού 104,5 °.
* αμμωνία (NH₃): Το άζωτο έχει ένα μοναδικό ζευγάρι και τρία ζεύγη συγκόλλησης. Η γεωμετρία τομέα ηλεκτρονίων είναι τετραεδρική. Το μοναδικό ζευγάρι ωθεί τα ζεύγη συγκόλλησης πιο κοντά, με αποτέλεσμα ένα τριγωνικό πυραμιδικό σχήμα.
Βασικά σημεία:
* Τα μοναχικά ζεύγη επηρεάζουν το μοριακό σχήμα λόγω των ισχυρών απωθητικών δυνάμεών τους.
* Τα μοναχικά ζεύγη καταλαμβάνουν περισσότερο χώρο από τα ζεύγη συγκόλλησης, οδηγώντας σε μια αλλαγή στις γωνίες δεσμών και το μοριακό σχήμα.
* Ο αριθμός των μοναχικών ζευγών επηρεάζει σημαντικά το μοριακό σχήμα.
Συνοπτικά, τα ζεύγη Lone συμβάλλουν στο μοριακό σχήμα με την άσκηση απωθητικών δυνάμεων σε ζεύγη συγκόλλησης, οδηγώντας σε παραμόρφωση της γεωμετρίας του τομέα των ηλεκτρονίων και σε μια μοναδική διάταξη ατόμων στο διάστημα.