Διαφορά μεταξύ υδρόλυσης και ενυδάτωσης
Κύρια διαφορά – Υδρόλυση έναντι ενυδάτωσης
Η υδρόλυση είναι η προσθήκη ενός μορίου νερού σε μια ένωση με διάσπαση του μορίου του νερού και διάσπαση ενός χημικού δεσμού στην ένωση. Επομένως, η υδρόλυση θεωρείται ως αντίδραση διπλής αποσύνθεσης. Ο όρος ενυδάτωση έχει δύο διαφορετικές εφαρμογές στην οργανική χημεία και στην ανόργανη χημεία. Στην οργανική χημεία, είναι η προσθήκη ενός μορίου νερού σε ένα αλκένιο ή αλκίνιο. Αλλά στην ανόργανη χημεία, η ενυδάτωση είναι ο συνδυασμός ή ο συνδυασμός μορίων νερού χωρίς να διασπαστεί το μόριο του νερού. Επομένως, η κύρια διαφορά μεταξύ υδρόλυσης και ενυδάτωσης είναι ότι η υδρόλυση περιλαμβάνει τη διάσπαση ενός μορίου νερού ενώ η ενυδάτωση δεν περιλαμβάνει πάντα τη διάσπαση ενός μορίου νερού .
Βασικές περιοχές που καλύπτονται
1. Τι είναι η Υδρόλυση
– Ορισμός, διαφορετικοί τύποι
2. Τι είναι η Ενυδάτωση
– Ορισμός, Εφαρμογές στην Οργανική και Ανόργανη Χημεία
3. Ποια είναι η διαφορά μεταξύ υδρόλυσης και ενυδάτωσης
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Αλκένιο, Αλκίνιο, Θεωρία οξέος-βάσης Brønsted-Lowry, Αντίδραση αποσύνθεσης, Ενυδάτωση, Υδρόλυση, Σταθερά Διαλυτότητας

Τι είναι η Υδρόλυση
Η υδρόλυση είναι μια αντίδραση διπλής αποσύνθεσης με το νερό ως ένα από τα αντιδρώντα. Με άλλα λόγια, είναι η διάσπαση ενός δεσμού σε ένα μόριο χρησιμοποιώντας ένα μόριο νερού. Οι αντιδράσεις υδρόλυσης είναι συχνά αναστρέψιμες. Υπάρχουν τρεις κύριοι τύποι αντιδράσεων υδρόλυσης:
- Όξινη υδρόλυση
- Βασική υδρόλυση
- Υδρόλυση αλατιού
Το νερό μπορεί να δράσει ως οξύ ή ως βάση σύμφωνα με τη θεωρία του οξέος Brønsted-Lowry (σύμφωνα με αυτή τη θεωρία, όταν ένα οξύ και μια βάση αντιδρούν μεταξύ τους, το οξύ σχηματίζεται η συζευγμένη βάση του, και η βάση σχηματίζει το συζευγμένο οξύ με ανταλλαγή πρωτονίου). Εάν το νερό δρα ως οξύ Brønsted-Lowry, τότε το μόριο του νερού δίνει ένα πρωτόνιο. Εάν λειτουργεί ως βάση Brønsted-Lowry, τότε το μόριο του νερού μπορεί να δεχθεί ένα πρωτόνιο, σχηματίζοντας ιόν υδρονίου (H3 Ο). Όξινη υδρόλυση μοιάζει με αντίδραση διάστασης οξέος.

Εικόνα 1:Υδρόλυση ηλεκτρικού ανυδρίτη
Υδρόλυση βάσης μοιάζει με αντίδραση διάστασης βάσης. Εδώ, το νερό δίνει ένα πρωτόνιο, παράγοντας ένα ανιόν υδροξειδίου (ΟΗ). Επομένως, το νερό δρα ως οξύ Brønsted-Lowry.
Όταν ένα αλάτι διαλύεται στο νερό, το αλάτι διασπάται στο ιόν του. Αυτή η διάσταση μπορεί να είναι είτε πλήρης διάσπαση είτε ατελής διάσταση με βάση τη σταθερά διαλυτότητας. Αλλά όταν ένα άλας ενός ασθενούς οξέος ή μιας ασθενούς βάσης διαλύεται στο νερό, το νερό μπορεί να ιονίσει το άλας και να σχηματίσει ανιόντα υδροξειδίου και κατιόντα υδρονίου. Το αλάτι διαχωρίζεται επίσης στα κατιόντα και τα ανιόντα του. Αυτό είναι γνωστό ως υδρόλυση αλατιού .
Τι είναι η ενυδάτωση
Η ενυδάτωση είναι μια χημική διαδικασία κατά την οποία τα μόρια του νερού ενώνονται με μια ουσία. Στην οργανική χημεία, η ενυδάτωση αναφέρεται στην προσθήκη ενός μορίου νερού σε μια ακόρεστη ένωση, ένα αλκένιο ή αλκίνιο. Αλλά στην ανόργανη χημεία, η ενυδάτωση αναφέρεται στη σύνδεση των μορίων του νερού με τις ενώσεις.
Στην οργανική χημεία, το μόριο του νερού προστίθεται στο σημείο όπου υπάρχει ακόρεστος. Εδώ, το μόριο του νερού διασπάται σε ένα πρωτόνιο και ένα ανιόν υδροξειδίου. Το ανιόν υδροξειδίου σχηματίζει δεσμό με το άτομο άνθρακα που έχει περισσότερους υποκαταστάτες. Το πρωτόνιο θα συνδυαστεί με τον λιγότερο υποκατεστημένο άνθρακα, σύμφωνα με τον κανόνα του Markovnikov. Οποιοδήποτε ακόρεστο οργανικό μόριο είναι ευαίσθητο στην ενυδάτωση.
Στην ανόργανη χημεία, η ενυδάτωση αναφέρεται στη σύνδεση των μορίων του νερού με μια ανόργανη ένωση. Για παράδειγμα, στη διαδικασία θειικών για την παραγωγή TiO2 χρωστικές από άμμο ιλμενίτη (FeTiO3 ), το FeSO4 σχηματίζεται ως υποπροϊόν. Αυτό το υποπροϊόν μέσω κρυστάλλωσης μέσω ενυδάτωσης. Εδώ, FeSO4 .7H2 Το Ο σχηματίζεται από την αντίδραση του FeSO4 με νερό και στη συνέχεια ψύξη στους 10C. Στη συνέχεια, FeSO4 .7H2 Σχηματίζονται κρύσταλλοι O, που αφαιρούνται εύκολα. Οι κρύσταλλοι είναι επταένυδρος θειικός σίδηρος.
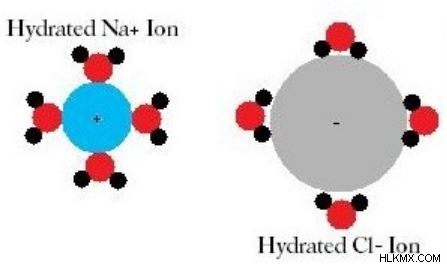
Εικόνα 2:Ένυδρο κατιόν νατρίου και ανιόν χλωρίου
Η ενυδάτωση είναι η χημική διαδικασία που συμβαίνει με τα ξηραντικά. Αποξηραντικό είναι κάθε ένωση που μπορεί να απορροφήσει υδρατμούς. Επιπλέον, ο όρος ενυδάτωση χρησιμοποιείται επίσης για να εξηγήσει τη διάλυση ιόντων άλατος όπως ιόντος νατρίου. Όταν ένα άλας διαλύεται στο νερό, το αλάτι διασπάται στα κατιόντα και τα ανιόντα του. Αυτά τα κατιόντα και τα ανιόντα διαχωρίζονται μεταξύ τους λόγω της ενυδάτωσης των ιόντων από τα μόρια του νερού. Εδώ, τα μόρια του νερού θα περιβάλλουν το ιόν άλατος, το οποίο ονομάζεται ενυδάτωση.
Διαφορά μεταξύ υδρόλυσης και ενυδάτωσης
Ορισμός
Υδρόλυση: Η υδρόλυση είναι μια αντίδραση διπλής αποσύνθεσης με νερό ως ένα από τα αντιδρώντα.
Ενυδάτωση: Η ενυδάτωση είναι μια χημική διαδικασία κατά την οποία τα μόρια του νερού ενώνονται με μια ουσία.
Χημικοί δεσμοί
Υδρόλυση: Η υδρόλυση λαμβάνει χώρα με διάσπαση δεσμού στο μόριο του νερού.
Ενυδάτωση: Η ενυδάτωση των οργανικών μορίων συμβαίνει με τη διάσπαση του δεσμού, αλλά στις ανόργανες ενώσεις, δεν πραγματοποιείται διάσπαση.
Φύση
Υδρόλυση: Η υδρόλυση σχηματίζει κορεσμένες ενώσεις από ακόρεστες ενώσεις.
Ενυδάτωση: Η ενυδάτωση σχηματίζει ένυδρες ενώσεις από αφυδατωμένες ενώσεις.
Συμπέρασμα
Η υδρόλυση και η ενυδάτωση είναι δύο διαφορετικοί όροι που συχνά συγχέουν οι μαθητές. Η κύρια διαφορά μεταξύ υδρόλυσης και ενυδάτωσης είναι ότι η υδρόλυση περιλαμβάνει τη διάσπαση ενός μορίου νερού, ενώ η ενυδάτωση δεν περιλαμβάνει πάντα τη διάσπαση ενός μορίου νερού.
Αναφορά:
1. «Υδρόλυση». Encyclopædia Britannica, Encyclopædia Britannica, inc., 16 Νοεμβρίου 2016, Διαθέσιμο εδώ.
2. "Hydrolysis." Chemistry LibreTexts, Libretexts, 21 Ιουλίου 2016, Διαθέσιμο εδώ.
3. "Hydrolysis." Wikipedia, Ίδρυμα Wikimedia, 24 Ιανουαρίου 2018, Διαθέσιμο εδώ.
Εικόνα Ευγενική προσφορά:
1. “Hydrolysis of Succinic Anhydride” By –Drdoht (συζήτηση) 00:26, 21 Φεβρουαρίου 2016 (UTC) – Ίδιο έργο (Δημόσιος Τομέας) μέσω Commons Wikimedia
2. “Hydration” By Kkeyshar – Own work (Public Domain) μέσω Commons Wikimedia