Τι είναι η μείωση του Clemmensen;
Η αναγωγή του Clemmensen είναι μια χημική αντίδραση που χρησιμοποιείται για την αναγωγή αλδεΰδων και κετονών σε απλούς υδρογονάνθρακες. Η αντίδραση προχωρά μέσω ενός ενδιάμεσου καρβανιόν. Η ένωση καρβονυλίου ψιλοκόβεται για να αυξηθεί το εμβαδόν της επιφάνειας της αντίδρασης, μετά από την οποία θερμαίνεται σε φλόγα. Η θερμότητα της φλόγας και ο καταλύτης που χρησιμοποιείται παρέχουν την απαραίτητη ενέργεια ενεργοποίησης για την αντίδραση. Ο συγχωνευμένος ψευδάργυρος χρησιμοποιείται ως καταλύτης σε αυτήν την αντίδραση.
Η αντίδραση αναγωγής του Clemmensen χρησιμοποιείται για την αναγωγή των καρβονυλικών ενώσεων σε απλούς υδρογονάνθρακες. Η αντίδραση προχωρά μέσω του ενδιάμεσου καρβανίου.
Οι οργανικές ενώσεις βρίσκονται παντού γύρω μας και αποτελούν τις βασικές ουσίες που χρησιμοποιούνται στην καθημερινή ζωή. Θα εκπλαγείτε από την ποσότητα της οργανικής χημείας που περιφέρεται γύρω σας σε τακτική βάση, ακόμη και αυτή τη στιγμή! Ανάμεσα στον κατάλογο αυτών των μορίων που υποστηρίζουν τη ζωή είναι ένα πολύ σημαντικό είδος που είναι γνωστό ως καρβονυλικές ενώσεις.
Τα καρβονύλια αποτελούνται κυρίως από δύο κατηγορίες ενώσεων - αλδεΰδες και κετόνες. Αυτά τα οργανικά μόρια υφίστανται πολυάριθμες αντιδράσεις, συμπεριλαμβανομένων των αντιδράσεων αναγωγής, όπως η αναγωγή του Clemmensen. Αυτό το άρθρο διερευνά την αντίδραση λεπτομερώς.
Τι είναι οι αλδεΰδες και οι κετόνες;
Οι αλδεΰδες και οι κετόνες είναι οργανικές ενώσεις που έχουν ενσωματωμένη την καρβονυλική ομάδα. Μια καρβονυλική ομάδα είναι αυτή στην οποία δύο από τα τέσσερα σθένη ενός ατόμου άνθρακα ικανοποιούνται από τον διπλό δεσμό με ένα άτομο οξυγόνου. Είναι τα άλλα δύο σθένη του άνθρακα που αποφασίζουν αν είναι αλδεΰδη ή κετόνη. Οι αλδεΰδες και οι κετόνες βρίσκονται σε μεγάλη ποικιλία στη φύση και πολλές από αυτές συντίθενται επίσης τεχνητά.
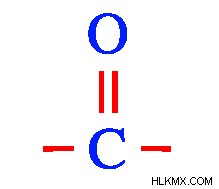
Γενική δομή των καρβονυλίων (Φωτογραφία:IUPAC/wikimedia commons)
Μιααλδεΰδη είναι μια ένωση με μια καρβονυλ ομάδα στο τέλος. Στις αλδεΰδες, η μία πλευρά της καρβονυλικής λειτουργικής ομάδας ικανοποιείται από ένα άτομο υδρογόνου, ενώ μια αλκυλομάδα γεμίζει την άλλη πλευρά. Οι αλκυλομάδες δεν είναι παρά απλές ενώσεις άνθρακα. Η ομάδα αλδεΰδης είναι επίσης γνωστή ως φορμύλιο ή μεθανόλη ομάδα.
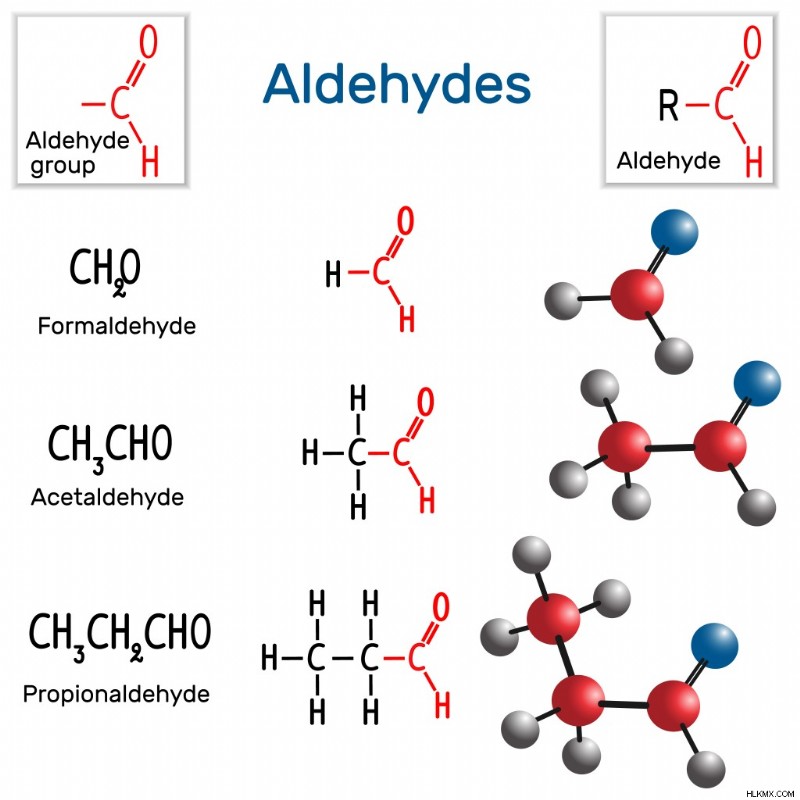
Δομή των αλδεΰδων (Φωτογραφία :Bacsica/Shutterstock)
Η βανιλίνη (βρίσκεται στη Βανίλια), η κινναμαλδεΰδη (από το φλοιό της κανέλας) και η βενζαλδεΰδη (που βρίσκεται στα αμύγδαλα) είναι μερικές από τις πιο κοινές φυσικές αλδεΰδες.
Κετόνες είναι καρβονυλικές ενώσεις στις οποίες αμφότερα τα υπόλοιπα σθένη της καρβονυλικής λειτουργικής ομάδας ικανοποιούνται από αλκύλια. Ως αποτέλεσμα, αυτές οι ενώσεις είναι βαρύτερες και πυκνότερες από τις αλδεΰδες.
Η καμφορά, η R-καρβόνη (από το έλαιο μέντας) και η ζ-γιασμόνη (που βρίσκεται στο γιασεμί) είναι μερικές φυσικές κετόνες που απαντώνται συνήθως.
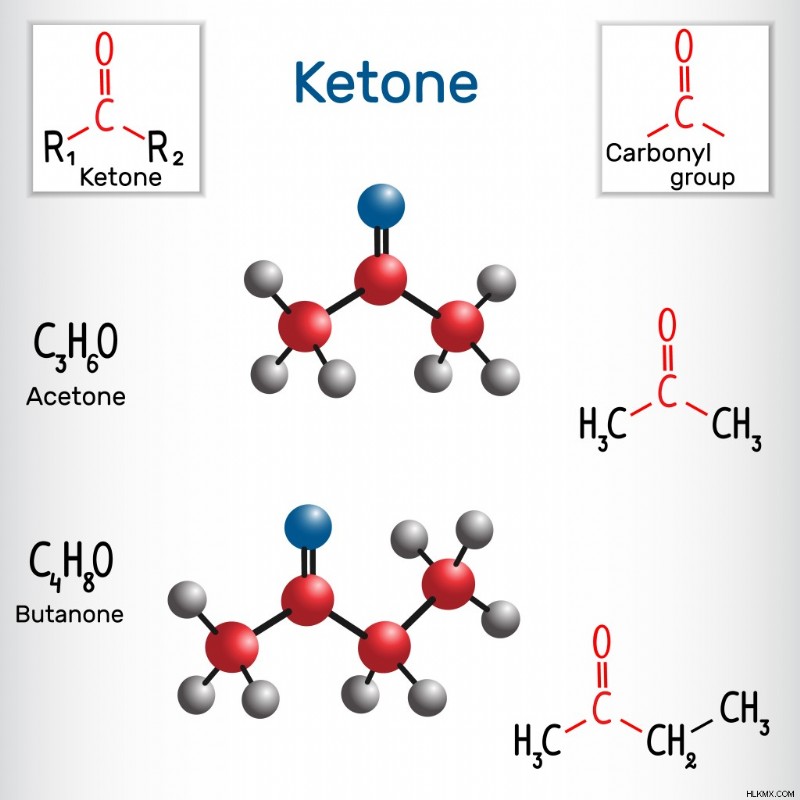
Δομή Κετόνης
(Φωτογραφία:Bacsica/Shutterstock)
Τι είναι η μείωση του Clemmensen;
Η αναγωγή του Clemmensen είναι μια χημική αντίδραση που χρησιμοποιείται για την αναγωγή αλδεΰδων και κετονών σε απλούς υδρογονάνθρακες. Θα μπορούσε κανείς να αναρωτηθεί… τι σημαίνει μείωση εδώ;
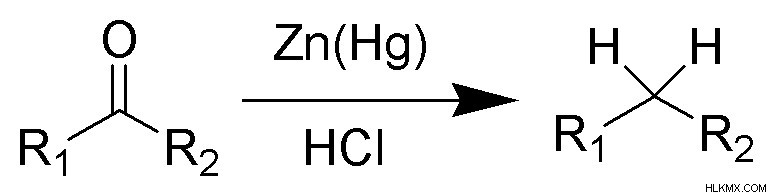
(Φωτογραφία:Pubic Domain/wikimedia commons)
Επιστημονικά, μια ένωση μειώνεται όταν αποκτά ηλεκτρόνια ή χάνει ένα ή περισσότερα άτομα οξυγόνου. Κατά τη διάρκεια των αναγωγών του Clemmensen, τόσο οι αλδεΰδες όσο και οι κετόνες χάνουν τις καρβονυλικές τους ομάδες και έτσι χάνουν ένα άτομο οξυγόνου. Στο εξής, θα λέμε ότι η αντίδραση του Clemmensen μειώνει τις αλδεΰδες και τις κετόνες.
Η ένωση καρβονυλίου ψιλοκόβεται για να αυξηθεί το εμβαδόν της επιφάνειας της αντίδρασης, μετά από την οποία θερμαίνεται σε φλόγα. Η θερμότητα της φλόγας και ο καταλύτης που χρησιμοποιείται παρέχουν την απαραίτητη ενέργεια ενεργοποίησης για την αντίδραση. Η ενέργεια ενεργοποίησης είναι η ελάχιστη ποσότητα ενέργειας που απαιτείται για την έναρξη μιας χημικής αντίδρασης.
Γιατί χρησιμοποιείται ο συγχωνευμένος ψευδάργυρος ως καταλύτης;
Ο συγχωνευμένος ψευδάργυρος είναι ψευδάργυρος διαλυμένος σε υδράργυρο και χρησιμοποιείται ως καταλύτης σε αυτή την αντίδραση. Ο ψευδάργυρος σε σκόνη ή τα κομμάτια του μετάλλου δεν μπορούν να χρησιμοποιηθούν για να καταλύσουν άμεσα τη μείωση, καθώς δεν ενεργοποιούνται αρκετά. Η προσθήκη υδραργύρου στον ψευδάργυρο κατανέμει ομοιόμορφα το μέταλλο σε όλο το αμάλγαμα, αυξάνοντας τον ρυθμό αντίδρασης και επίσης αυξάνοντας την ενέργεια ενεργοποίησης του ψευδαργύρου σε ένα επίπεδο απαραίτητο για την πρόοδο της αντίδρασης.
Επίσης, ο καθαρός ψευδάργυρος θα αντιδρούσε γρήγορα με το υδροχλωρικό οξύ που υπάρχει, σχηματίζοντας χλωριούχο ψευδάργυρο και απελευθερώνοντας σταθερό αέριο υδρογόνο που θα διαφεύγει γρήγορα από τη ζώνη αντίδρασης. Ωστόσο, όταν αυτή η αντίδραση προχωρά με αμάλγαμα ψευδαργύρου, τα μεμονωμένα μόρια υδρογόνου που σχηματίζονται από την αντίδραση HCL με ψευδάργυρο παραμένουν σε αντιδραστική κατάσταση (μερικές φορές αποκαλείται «ενισχυόμενο υδρογόνο») και αντιδρούν με την καρβονυλική ένωση (κετόνη ή αλδεΰδη) για να ξεκινήσει η αναγωγή. αντίδραση.
Μηχανισμός της διαδικασίας
Ο μηχανισμός αντίδρασης της μείωσης του Clemmensen είναι ακόμη συζητήσιμος σε ορισμένα επίπεδα, αλλά η πλειοψηφία της επιστημονικής κοινότητας αποδέχεται τον ακόλουθο μηχανισμό.
καρβανιονικός μηχανισμός
Η αναγωγή πιστεύεται ότι προχωρά με την πρωτονίωση (προσθήκη ιόντος υδρογόνου) της καρβονυλικής λειτουργικής ομάδας στην επιφάνεια του μετάλλου Zn, οδηγώντας στο σχηματισμό ενός ενδιάμεσου οργανοψευδαργύρου (Α). Περαιτέρω πρωτονίωση αυτού του ενδιάμεσου έχει ως αποτέλεσμα την απομάκρυνση ενός μορίου νερού και μια σταδιακή μεταφορά ηλεκτρονίων από εδώ οδηγεί στο σχηματισμό ενός οργανομεταλλικού καρβανιόντος. Τα καρβανιόν είναι οργανικά είδη με περίσσεια ηλεκτρονίων, γεγονός που τα καθιστά εξαιρετικά ασταθή (βραχύχρονα) και επομένως αντιδραστικά.
 Το καρβανιόν συνδυάζεται αμέσως με ένα πρωτόνιο για να σχηματίσει ιόντα αλκυλ ψευδάργυρου, τα οποία περαιτέρω δέχονται ένα πρωτόνιο για να δώσουν το τελικό προϊόν, αλκάνιο. Στην περίπτωση κυκλικών οργανικών μορίων, όπως η βενζαλδεΰδη, η αντίδραση ακολουθεί μια παρόμοια διαδρομή που προχωρά μέσω ενός ενδιάμεσου καρβενίου ή καρβενοειδούς. Το προϊόν που προκύπτει μπορεί να είναι κυκλικό ή ανοιχτής αλυσίδας.
Το καρβανιόν συνδυάζεται αμέσως με ένα πρωτόνιο για να σχηματίσει ιόντα αλκυλ ψευδάργυρου, τα οποία περαιτέρω δέχονται ένα πρωτόνιο για να δώσουν το τελικό προϊόν, αλκάνιο. Στην περίπτωση κυκλικών οργανικών μορίων, όπως η βενζαλδεΰδη, η αντίδραση ακολουθεί μια παρόμοια διαδρομή που προχωρά μέσω ενός ενδιάμεσου καρβενίου ή καρβενοειδούς. Το προϊόν που προκύπτει μπορεί να είναι κυκλικό ή ανοιχτής αλυσίδας.
Προφυλάξεις που πρέπει να λαμβάνονται κατά τη μείωση του Clemmensen
Η αναγωγή του Clemmensen δεν είναι κατάλληλη για ουσίες ευαίσθητες στα οξέα. Εάν το μόριο του αντιδραστηρίου ενσωματώνει μια ευαίσθητη στο οξύ ομάδα, όπως η ομάδα υδροξυλίου (-ΟΗ), τα ιόντα υδρογόνου θα τους επιτεθούν αντί να επιτεθούν στην ομάδα καρβονυλίου, με αποτέλεσμα την αποτυχία της αντίδρασης.
Και πάλι, αυτή η λειτουργία δεν μπορεί να χρησιμοποιηθεί για την αναγωγή των καρβοξυλικών οξέων, καθώς το πρωτόνιο δεν θα επιτεθεί στον αντιδραστικό άνθρακα της ομάδας οξέος. Αντίθετα, μπορεί να χρησιμοποιηθεί για τον ίδιο σκοπό.




