Πώς να βρείτε το περιοριστικό αντιδραστήριο σε μια χημική αντίδραση;
Το περιοριστικό αντιδραστήριο (ή αντιδραστήριο) σε μια αντίδραση βρίσκεται με τον υπολογισμό της ποσότητας του προϊόντος που παράγεται από κάθε αντιδραστήριο. Το αντιδραστήριο που παράγει τη μικρότερη ποσότητα προϊόντος είναι το περιοριστικό αντιδραστήριο.
Υπάρχουν πολλά πράγματα που πρέπει να γίνουν σωστά προκειμένου μια χημική αντίδραση να δώσει χρήσιμα προϊόντα:από το περιβάλλον που περιβάλλει την αντίδραση μέχρι την ποσότητα των αντιδρώντων που υπάρχουν. Μόνο μία φορά σε ένα μπλε φεγγάρι όλα τα αντιδρώντα μετατρέπονται σε προϊόντα.
Στις περισσότερες αντιδράσεις, ένα αντιδραστήριο (το αντιδραστήριο και το αντιδραστήριο χρησιμοποιούνται εναλλακτικά) εξαντλείται πλήρως, ενώ κάποια ποσότητα από τα άλλα αντιδραστήρια παραμένει διαθέσιμη για περαιτέρω αντίδραση.
Δεδομένου ότι ένα από τα αντιδρώντα δεν είναι πάντα διαθέσιμο, η αντίδραση χτυπά ένα οδόφραγμα και δεν συνεχίζεται. Αυτό το αντιδραστήριο που εξαντλείται πλήρως και επομένως περιορίζει την προώθηση της αντίδρασης προς τα εμπρός, ονομάζεται περιοριστικό αντιδραστήριο ή περιοριστικό αντιδραστήριο.

Το περιοριστικό αντιδραστήριο σε μια χημική αντίδραση ελέγχει πόσο από το τελικό προϊόν θα παραχθεί.
Τι είναι το περιοριστικό αντιδραστήριο;
Με βάση τις ποσότητες και τους ρόλους τους, ταξινομούμε τα αντιδρώντα σε δύο είδη:περιοριστικά αντιδρώντα και περίσσεια αντιδρώντων .
Τα περιοριστικά αντιδραστήρια είναι εκείνα που χρησιμοποιούνται πλήρως σε μια αντίδραση πρώτα και έτσι περιορίζουν την ποσότητα του προϊόντος που θα παραχθεί. Η περίσσεια αντιδρώντων, από την άλλη πλευρά, είναι τα αντιδρώντα που εξακολουθούν να υπάρχουν μετά την ακινητοποίηση της αντίδρασης.
Ας πούμε ότι στέκεστε σε μια ουρά στον αγαπημένο σας πωλητή κουλούρι. Ο τύπος κουλούρι βγαίνει από το καρότσι και ανακοινώνει ότι του απομένουν μόνο 10 κουλούρια. Τώρα, κοιτάζετε από το τηλέφωνό σας και αρχίζετε να μετράτε τον αριθμό των ατόμων που βρίσκονται μπροστά σας στην ουρά. Μετράτε συνολικά 20 άτομα, δηλαδή 10 περισσότερα από τον αριθμό των κουλούρι που έχουν απομείνει.
Στο παράδειγμά μας, οι πελάτες που στέκονται στην ουρά και τα κουλούρια είναι αντιδραστήρια, που ενώνονται για να παράγουν άτομα που τρέφονται με χαρά (τελικό προϊόν).
Ωστόσο, ο αριθμός των bagels θα περιορίσει τον αριθμό των ευχαριστημένων πελατών που μπορεί να επιτευχθεί τελικά, καθιστώντας τον περιοριστικό παράγοντα (παράγοντα), ενώ οι πελάτες θα θεωρούνται τα πλεονάζοντα αντιδρώντα.
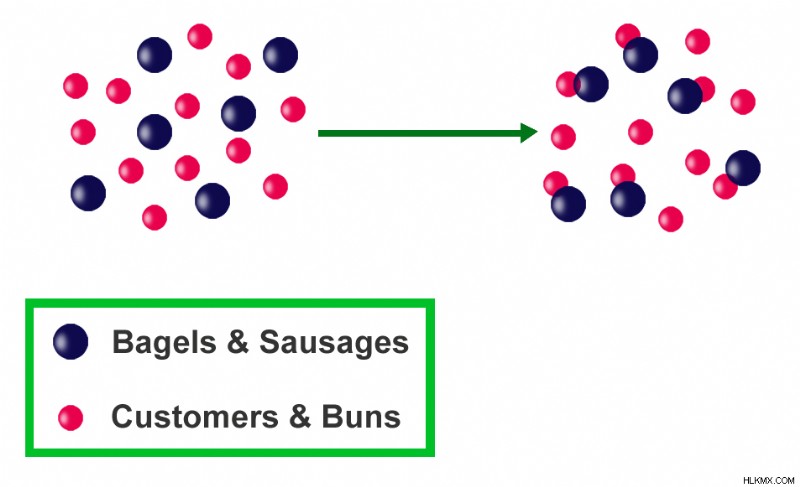
Ένα άλλο παράδειγμα είναι ο αριθμός των ψωμιών και των λουκάνικων που χρειάζονται για την παρασκευή ενός χοτ ντογκ. Χρειάζεται και ένα τσουρέκι και ένα λουκάνικο για να φτιάξεις ένα χοτ ντογκ. Ένας άνισος αριθμός ειδών (αντιδρών) θα έχει ως αποτέλεσμα ανεπαρκή αριθμό χοτ ντογκ (προϊόν). Με 10 κουλούρια και 5 λουκάνικα, θα μπορούμε να παράγουμε μόνο 5 χοτ ντογκ και θα μας απομένουν 5 ψωμάκια. Τα ψωμάκια είναι διαθέσιμα σε υπερβολική ποσότητα, ενώ τα λουκάνικα είναι ο περιοριστικός παράγοντας, που ελέγχει τον αριθμό των χοτ ντογκ που μπορούν να παρασκευαστούν.
Πώς να βρείτε το περιοριστικό αντιδραστήριο;
Υπάρχουν μερικοί τρόποι με τους οποίους μπορεί κανείς να προσδιορίσει τα περιοριστικά και την περίσσεια αντιδρώντων σε μια αντίδραση. Ωστόσο, οι μέθοδοι συνοδεύονται από μια προϋπόθεση, η οποία είναι να έχετε μια ισορροπημένη χημική εξίσωση στο χέρι.
Οι μέθοδοι χρησιμοποιούν στοιχειομετρικούς συντελεστές από την ισορροπημένη χημική εξίσωση για τον υπολογισμό των αναλογιών. Εάν οι ίδιοι οι συντελεστές είναι λανθασμένοι, οι τελικές απαντήσεις που λαμβάνονται θα είναι επίσης λανθασμένες.
Στην πρώτη μέθοδο θα βρούμε και θα συγκρίνουμε τις γραμμομοριακές αναλογίες των αντιδρώντων, ενώ στην άλλη θα βρούμε την ποσότητα του προϊόντος που θα παραχθεί από κάθε αντιδρών. Αυτό που παράγει τη μικρότερη ποσότητα του τελικού προϊόντος είναι το περιοριστικό αντιδραστήριο.
Μέθοδος 1:Χρήση αναλογιών Mole
Ας εφαρμόσουμε αυτή τη μέθοδο στην αντίδραση της αμμωνίας (NH3) και του μοριακού οξυγόνου (O2) για να υπολογίσουμε το περιοριστικό αντιδραστήριο των δύο. Η αντίδραση μεταξύ NH3 και O2 αποδίδει NO (νιτρικό οξείδιο) και H2O (νερό). Η ισορροπημένη χημική εξίσωση για την αντίδραση είναι:
4NH3 + 5O2 → 4NO + 6H2O
Η εξίσωση διαβάζεται ως 4 moles αμμωνίας απαιτούν 5 moles οξυγόνου για να παραχθούν 4 moles νιτρικού οξέος και 6 mole νερού.
Ξεκινάμε βρίσκοντας τη στοιχειομετρική αναλογία των αντιδρώντων. Για να γίνει αυτό, απλώς διαιρούμε τους στοιχειομετρικούς συντελεστές κάθε αντιδρώντος. Για την αμμωνία, ο στοιχειομετρικός συντελεστής είναι 4, ενώ για το οξυγόνο είναι 5.
Στοιχειομετρική αναλογία =4 mole αμμωνίας / 5 mole οξυγόνου =0,8 mole αμμωνίας / 1 mole οξυγόνου
Αυτό σημαίνει ότι χρειαζόμαστε 0,8 moles αμμωνίας για κάθε mole οξυγόνου.
Στη συνέχεια, βρίσκουμε τις γραμμομοριακές αναλογίες των αντιδρώντων. Στα περισσότερα σενάρια, οι ποσότητες των αντιδρώντων θα παρέχονται σε γραμμάρια. Μετατρέπουμε τις τιμές γραμμαρίων σε moles και μετά συνεχίζουμε προς την εύρεση του περιοριστικού αντιδραστηρίου. Ας υποθέσουμε ότι έχουμε 100 γραμμάρια αμμωνίας και οξυγόνου το καθένα. Για να το μετατρέψουμε σε mole, διαιρούμε αυτές τις τιμές με τις μοριακές τους μάζες.
Για την αμμωνία, ο αριθμός των mol =(100 g) / (17,04 g/mol) =5,86 mol
Για το οξυγόνο, ο αριθμός των mol =(100 g) / (32 g/mol) =3,125 mol
Μπορούμε να συνεχίσουμε με δύο τρόπους. Το ένα, υποθέτοντας ένα περιοριστικό αντιδραστήριο και βρίσκοντας τον αριθμό των γραμμομορίων άλλων αντιδραστηρίων που απαιτούνται, ή το άλλο, βρίσκοντας την πραγματική αναλογία και εξάγοντας ένα συμπέρασμα από την τιμή του. Ας ακολουθήσουμε την πρώτη διαδρομή και ας υποθέσουμε ότι η αμμωνία είναι το περιοριστικό αντιδραστήριο.
Υποθέτοντας ότι η αμμωνία καταναλώνεται πρώτη, (5,86 moles αμμωνίας) / Στοιχειομετρική αναλογία =4,688 mole οξυγόνου απαιτούνται.

Αλλά έχουμε μόνο 3.125 γραμμομόρια οξυγόνου διαθέσιμα για την αντίδραση, οπότε θα ξεμείνουμε από οξυγόνο πριν από την αμμωνία. Επομένως, το οξυγόνο είναι το περιοριστικό αντιδραστήριο και η αμμωνία είναι διαθέσιμη σε περίσσεια.
Μέθοδος 2:Συγκρίνοντας την ποσότητα του προϊόντος που παράγεται από κάθε αντιδρών
Όπως και στην προηγούμενη μέθοδο, ξεκινάμε με μια ισορροπημένη χημική εξίσωση και συνεχίζουμε προσδιορίζοντας τον αριθμό των γραμμομορίων κάθε αντιδρώντος. Θα χρησιμοποιήσουμε τις ίδιες τιμές με αυτές που βρέθηκαν στην προηγούμενη μέθοδο.
Ο αριθμός γραμμομορίων αμμωνίας =5,86 mol &ο αριθμός γραμμομορίων οξυγόνου =3,125 mol.
Τώρα βρίσκουμε την ποσότητα του τελικού προϊόντος (ΝΟ) που θα παράγει κάθε αντιδρών.
Για την αμμωνία, τα mol νιτρικού οξειδίου (NO) =Moles NH3 διαθέσιμα × Στοιχειομετρικός συντελεστής NO/ στοιχειομετρικός συντελεστής NH3 =5,86 × 4/4 =5,86 mol NO
Για το οξυγόνο, τα mol νιτρικού οξειδίου (NO) =Moles διαθέσιμου O2 × Στοιχειομετρικός συντελεστής NO/ στοιχειομετρικός συντελεστής O2 =3,125 × 4/5 =2,5 mol NO
Δεδομένου ότι η ποσότητα του προϊόντος που παράγεται από το οξυγόνο είναι μικρότερη από αυτή που παράγεται από την αμμωνία, το οξυγόνο είναι το περιοριστικό αντιδραστήριο και η αμμωνία είναι σε περίσσεια.
Τελικές λέξεις
Όπως μπορούμε να δούμε, το περιοριστικό αντιδραστήριο ή το περιοριστικό αντιδραστήριο σε μια αντίδραση είναι το αντιδραστήριο που εξαντλείται πλήρως και έτσι εμποδίζει τη συνέχιση της αντίδρασης προς τα εμπρός. Καθορίζει επίσης την ποσότητα του τελικού προϊόντος που θα παραχθεί.
Η εύρεση του περιοριστικού αντιδραστηρίου είναι ένα σημαντικό βήμα για την εύρεση της ποσοστιαίας απόδοσης της αντίδρασης. Η ποσοστιαία απόδοση μιας αντίδρασης είναι ο λόγος της πραγματικής της απόδοσης προς τη θεωρητική της απόδοση επί 100. Θεωρητική απόδοση είναι η απόδοση που προβλέπεται από στοιχειομετρικούς υπολογισμούς, υποθέτοντας ότι το περιοριστικό αντιδραστήριο αντιδρά πλήρως.
Με πιο απλά λόγια, είναι η ποσότητα του προϊόντος που παράγεται από το περιοριστικό αντιδραστήριο. Στην περίπτωσή μας, το περιοριστικό αντιδραστήριο είναι το οξυγόνο και η ποσότητα του προϊόντος (ΝΟ) που παράγεται από αυτό είναι 2,5 moles. Έτσι, η θεωρητική απόδοση για την αντίδραση είναι 2,5 moles.
Η πραγματική απόδοση είναι η ποσότητα του τελικού προϊόντος που λαμβάνεται κατά τον πειραματισμό. Ας υποθέσουμε ότι η πραγματική απόδοση που λάβαμε στον πειραματισμό ως 2 moles. Η ποσοστιαία απόδοση θα είναι τότε:
Ποσοστιαία απόδοση =(Πραγματική απόδοση/Θεωρητική απόδοση) × 100 =(2/2,5) × 100 =80%
Η θεωρητική απόδοση που υπολογίζεται είναι συνήθως υψηλότερη από την πραγματική απόδοση που παράγεται. Αυτό συμβαίνει για διάφορους λόγους, συμπεριλαμβανομένης της αναστρέψιμης φύσης των αντιδράσεων, της παραγωγής ανεπιθύμητων παραπροϊόντων, των σφαλμάτων στις διαδικασίες καθαρισμού κ.λπ.




