Τι είναι η Υδρόλυση;
Βασικές έννοιες
Σε αυτό το άρθρο, θα μάθετε τα βασικά της υδρόλυσης, συμπεριλαμβανομένης της χημείας και της μηχανικής της. Θα μάθετε επίσης τους μηχανισμούς βήμα προς βήμα μερικών από τους πιο σημαντικούς μηχανισμούς, καθώς και παραδείγματα που χρησιμοποιούν βιομόρια.
Δραστικότητα του νερού
Συχνά μας αρέσει να θεωρούμε το νερό (H2O) ως βαρετό, απλό και καταπονητικό. τελικά δεν έχει καν γεύση! Εκτός από την περιστασιακή πλημμύρα, το τσουνάμι ή το ρυάκι, το νερό φαίνεται σαν κάποιο αδρανές, μη απειλητικό υγρό, παρόλο που είναι τόσο θεμελιώδες για τη βιολογία και τη γεωλογία.
Με την κατανόηση της χημείας, ωστόσο, η συναρπαστική δύναμη του νερού απελευθερώνεται. Όταν έρχεται σε επαφή με ορισμένες ενώσεις, το νερό μπορεί να σχηματίσει όξινα ή βασικά διαλύματα που μπορούν να διαβρώσουν το μέταλλο και να κάψουν χημικά τη σάρκα. Όταν έρχεται σε επαφή με ορισμένα μεταλλικά κατιόντα, το νερό μπορεί να χρησιμεύσει ως συνδέτης και να παράγει σύμπλοκα αλάτων με λαμπρό χρώμα. Πιο σχετικό με το σημερινό θέμα, το νερό μπορεί επίσης να αλλάξει θεμελιωδώς τη δομή των αλάτων και των οργανικών ενώσεων, καθιστώντας το ένα σημαντικό αντιδραστήριο στην οργανική σύνθεση και τα βιοχημικά συστήματα.
Η χρησιμότητα του νερού προέρχεται από το βασικότερο χαρακτηριστικό του:την πολική του δομή. Με αυτή την πολικότητα, το νερό μπορεί να χρησιμεύσει ως πυρηνόφιλο, και δευτερευόντως ως ηλεκτρόφιλο, σε οργανικές αντιδράσεις. Η πιο σημαντική κατηγορία οργανικών αντιδράσεων που χρησιμοποιούν το νερό ως πυρηνόφιλο ονομάζεται «υδρόλυση». Ο ορισμός της υδρόλυσης είναι η διάσπαση ενός χημικού δεσμού μέσω μιας αντίδρασης με το νερό. Είναι σημαντικό ότι μόνο οι ιοντικοί δεσμοί και οι εξαιρετικά πολικοί δεσμοί μπορούν να «υδρολύονται», που σημαίνει ότι διασπώνται με νερό.
Ας ρίξουμε μια προσεκτική ματιά στον μηχανισμό για την υδρόλυση.
Τι είναι η Υδρόλυση;
Υδρόλυση αλατιού
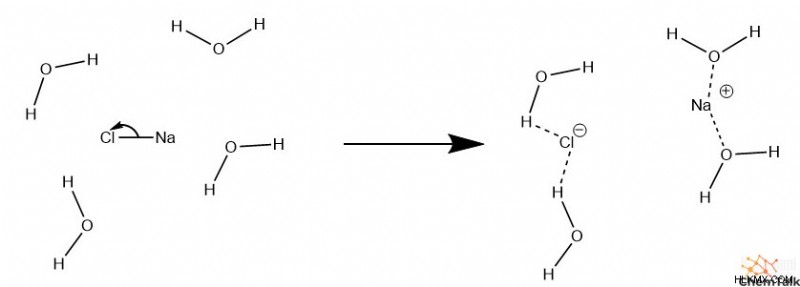
Ο πιο βασικός μηχανισμός για την υδρόλυση περιλαμβάνει μόνο δεσμούς υδρογόνου. Τυπικά, αυτός ο μηχανισμός σπάει μόνο ιοντικούς δεσμούς, όπως αυτοί των αλάτων. Είναι σημαντικό ότι αυτός ο μηχανισμός συμβαίνει όταν το επιτραπέζιο αλάτι, NaCl, απορρίπτεται σε υγρό νερό. Ο ιοντικός δεσμός ενός άλατος μπορεί να σπάσει εάν τα θετικά και τα αρνητικά του ιόντα έχουν μεγαλύτερη ηλεκτροστατική έλξη στις πολικές περιοχές του νερού από ό,τι στον εαυτό τους. Τα άλατα με ασθενέστερους ιοντικούς δεσμούς τείνουν επομένως να είναι πιο «διαλυτά» ή πιο εύκολα διασπώνται σε διαλύτη νερού.
Οργανική υδρόλυση
Οι μηχανισμοί για την υδρόλυση οργανικών ενώσεων είναι λίγο πιο περίπλοκοι. Η υδρόλυση μπορεί να συμβεί υπό συνθήκες όξινης κατάλυσης ή κατάλυσης βάσης, αλλά ο μηχανισμός είναι λίγο διαφορετικός για το καθένα. Γενικά, η υδρόλυση λαμβάνει χώρα μόνο σε αμίδια και εστέρες, καθώς μόνο αυτές οι ομάδες λειτουργιών έχουν επαρκή πολικό χαρακτήρα. Οι αμινο και καρβοξυ ομάδες, αντίστοιχα, χρησιμεύουν ως ηλεκτραρνητικές ομάδες αποχώρησης.
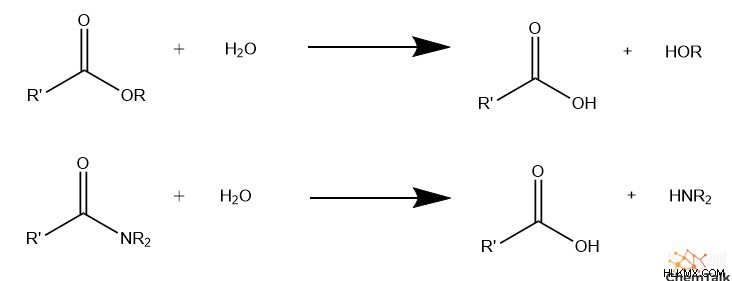
Η οργανική υδρόλυση ακολουθεί αυτή τη βασική εξίσωση αντίδρασης:
CE + H2 O → COH + HE
Ε:Ηλεκτραρνητική αποχωρούσα ομάδα, συχνά αμινο ή καρβοξυ
Γ:Ηλεκτροθετική ομάδα, συχνά καρβονυλ
Υδρόλυση καταλυόμενη από οξύ
Στον μηχανισμό που καταλύεται από οξύ, το πρώτο βήμα περιλαμβάνει νερό ή κάποιο γενόσημο οξύ που πρωτονιώνει το καρβονύλιο και την αποχωρούσα ομάδα, καθιστώντας και τα δύο θετικά.
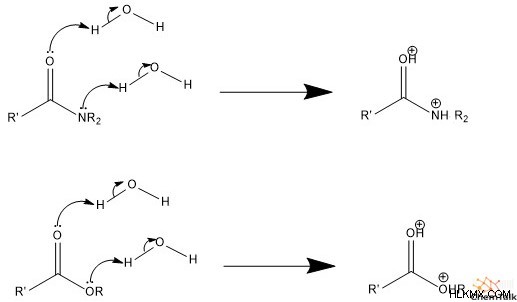
Δεύτερον, το νερό επιτίθεται στον άνθρακα, ενεργώντας ως πυρηνόφιλο. Αυτό ωθεί τα ηλεκτρόνια του δεσμού pi που εμπλέκονται στο καρβονύλιο στο παρακείμενο οξυγόνο, εξουδετερώνοντας το θετικό φορτίο. Τρίτον, η ομάδα νερού που επιτίθεται αποπρωτονίζεται, είτε με νερό είτε από κάποια γενική βάση, δημιουργώντας ένα είδος διόλης (δύο αλκοόλης).
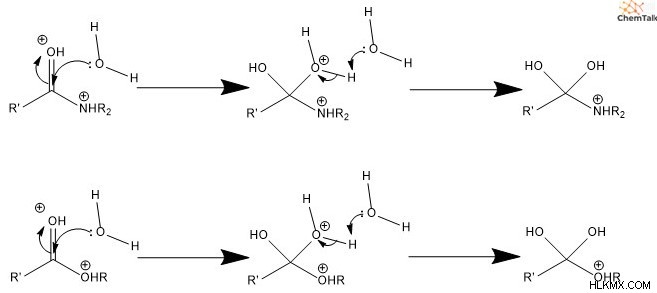
Τέταρτον, μία από τις διόλες μετατρέπεται σε καρβονύλιο. Αυτό περιλαμβάνει ένα ελεύθερο ζεύγος ηλεκτρονίων στο οξυγόνο που σχηματίζει διπλό δεσμό με τον άνθρακα, ωθώντας προς τα έξω την αποχωρούσα ομάδα. Πέμπτον, το νεοσχηματισμένο καρβονύλιο αποπρωτονίζεται, με αποτέλεσμα ένα ουδέτερα φορτισμένο καρβοξυλικό οξύ.
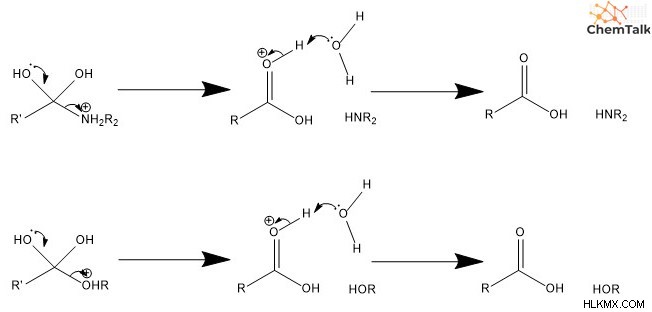
Υδρόλυση καταλυόμενης βάσης
Στον μηχανισμό που καταλύεται από βάση, το πρώτο βήμα περιλαμβάνει νερό ή κάποιο υδροξείδιο που επιτίθεται στον άνθρακα, ωθώντας ένα ζεύγος ηλεκτρονίων πάνω στο καρβονυλικό οξυγόνο. Εάν το νερό χρησιμεύει ως επιτιθέμενο είδος, αποπρωτονίζεται γρήγορα. Δεύτερον, η ομάδα του οξειδίου μεταμορφώνεται σε καρβονύλιο, ωθώντας προς τα έξω την αποχωρούσα ομάδα, με αποτέλεσμα ένα ουδέτερα φορτισμένο καρβοξυλικό οξύ.
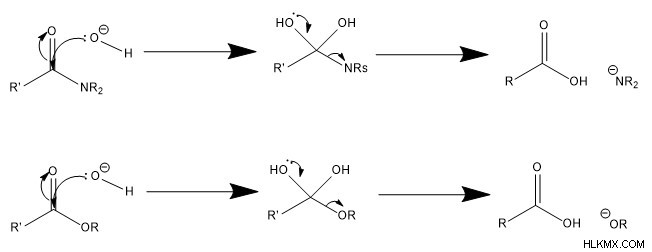
Υδρόλυση σε Βιομόρια
Στους οργανισμούς, τα βιομόρια ακολουθούν γενικά τους μηχανισμούς για την υδρόλυση που καταλύεται από οξύ και βάση. Στους οργανισμούς, σημαντικά ένζυμα που ονομάζονται υδρολάσες καταλύουν αυτές τις αντιδράσεις υδρόλυσης. Είναι σημαντικό ότι η υδρόλυση χρησιμεύει ως το κύριο μέσο διάσπασης μεγάλων μορίων πολυμερούς. Με αυτόν τον τρόπο, πολλοί σκέφτονται την υδρόλυση ως το αντίθετο της σύνθεσης αφυδάτωσης, η οποία περιλαμβάνει την κατασκευή πολυμερών μέσω αντιδράσεων συμπύκνωσης. Ας ρίξουμε μια ματιά στα πιο σημαντικά παραδείγματα υδρόλυσης σε βιομόρια.
H υδρόλυση υδατανθράκων
Για να διαχωριστούν δύο μονομερή μονοσακχαριτών, πρέπει να συμβεί μια αντίδραση υδρόλυσης για να σπάσει ο γλυκοσιδικός δεσμός. Είναι σημαντικό ότι αυτοί οι δεσμοί δεν περιλαμβάνουν ομάδες καρβονυλίου, επομένως λαμβάνει χώρα μια τροποποιημένη έκδοση του προηγούμενου μηχανισμού.
Μπορεί να λάβει χώρα υδρόλυση που καταλύεται τόσο από οξύ όσο και από βάση. Στην υδρόλυση υδατανθράκων που καταλύεται από οξύ, το οξυγόνο του γλυκοσιδικού δεσμού πρωτονιώνεται. Στη συνέχεια, το νερό δρα ως πυρηνόφιλο και επιτίθεται σε έναν από τους άνθρακες, σπάζοντας τον δεσμό μεταξύ των υδατανθράκων. Το επιτιθέμενο νερό στη συνέχεια αποπρωτονιώνεται, ολοκληρώνοντας την όξινη κατάλυση.
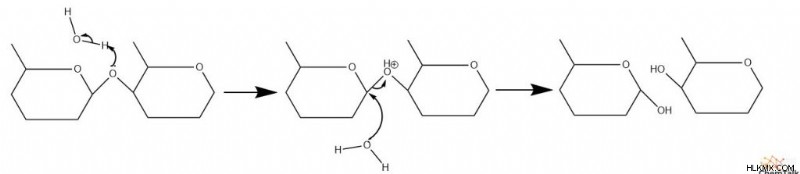
Ο μηχανισμός που καταλύεται με βάση είναι κάπως παρόμοιος. Το υδροξείδιο προσβάλλει έναν άνθρακα, σπάζοντας τον γλυκοσιδικό δεσμό. Το υπόλοιπο οξείδιο στη συνέχεια πρωτονιώνεται.

H υδρολυτικά λιπίδια
Για να διασπάσουν τα τριγλυκερίδια ή τα φωσφολιπίδια, οι οργανισμοί εκτελούν αντιδράσεις υδρόλυσης για να σπάσουν τους δεσμούς μεταξύ των λιπαρών οξέων και της γλυκερίνης. Δεδομένου ότι αυτοί οι δεσμοί περιλαμβάνουν εστερικές ομάδες, οι μηχανισμοί που καταλύονται από οξύ και βάση που καλύψαμε προηγουμένως εξηγούν πλήρως πώς λαμβάνουν χώρα αυτές οι υδρόλυση.
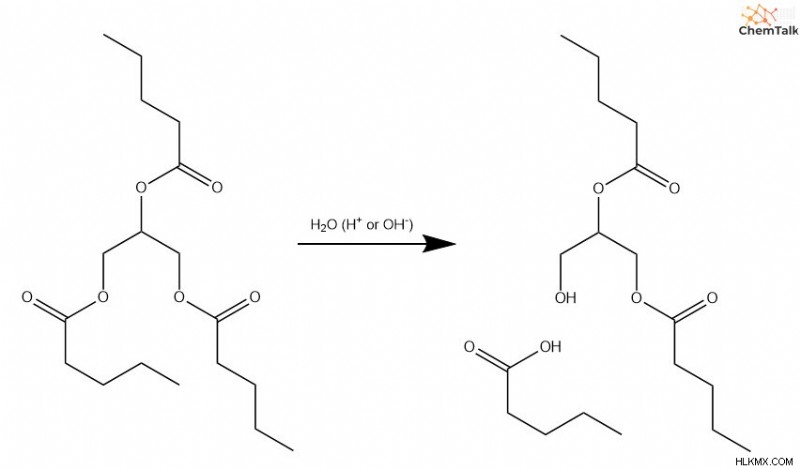
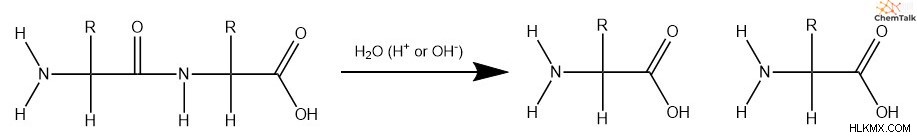
H υδρολυτικές πρωτεΐνες
Για να διασπαστούν οι πρωτεΐνες, πρέπει να συμβούν αντιδράσεις υδρόλυσης για να σπάσουν οι πεπτιδικοί δεσμοί μεταξύ των αμινοξέων. Όπως και με τα λιπίδια, οι προηγούμενοι μηχανισμοί λειτουργούν καλά για να εξηγήσουν αυτές τις αντιδράσεις, καθώς οι πεπτιδικοί δεσμοί περιλαμβάνουν ομάδες αμιδίου.
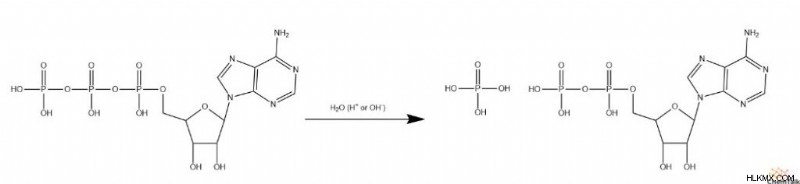
H υδρόλυση ATP
Η υδρόλυση των φωσφορικών αλάτων του ATP διαδραματίζει κρίσιμο ρόλο στην παροχή ενέργειας για δυσμενείς βιοχημικές αντιδράσεις. Σε αντίθεση με τα άλλα παραδείγματα υδρόλυσης, το ATP περιλαμβάνει έναν μηχανισμό που δεν περιλαμβάνει άνθρακα. Αντίθετα, οι πολικοί δεσμοί που σπάνε είναι φωσφοδιεστερικοί δεσμοί, μεταξύ οξυγόνου και φωσφόρου. Οι μηχανισμοί που καταλύονται από οξύ και βάση εξακολουθούν να ισχύουν σε γενικές γραμμές, αλλά ο φώσφορος αντικαθιστά πλήρως τον άνθρακα.