Τι είναι ο κανόνας της Οκτάδας;
Ο κανόνας της οκτάδας δηλώνει ότι τα άτομα τείνουν να προτιμούν να έχουν 8 ηλεκτρόνια στο κέλυφος σθένους τους προκειμένου να διαθέτουν ηλεκτρονική διαμόρφωση παρόμοια με το πλησιέστερο ευγενές αέριο.
Ο κανόνας της οκτάδας είναι ένας από τους χημικούς «εμπειρικούς κανόνες» που δηλώνει ότι τα άτομα προτιμούν να συνδυάζονται με τέτοιο τρόπο ώστε κάθε άτομο να έχει 8 ηλεκτρόνια στη στιβάδα σθένους. Ένα κέλυφος σθένους είναι το εξωτερικό κέλυφος ενός ατόμου. Οκτώ ηλεκτρόνια στο εξωτερικό περίβλημα επιτρέπουν στα άτομα να έχουν μια διαμόρφωση παρόμοια με το πλησιέστερο ευγενές αέριο. Αυτό, με τη σειρά του, τα καθιστά πιο σταθερά.
Για να έχουν 8 ηλεκτρόνια στο κέλυφος σθένους, τα άτομα τείνουν να σχηματίζουν ομοιοπολικούς ή ιοντικούς δεσμούς. Ο ιοντικός δεσμός παρατηρείται στο χλωριούχο νάτριο ή στο αλάτι, ενώ ο ομοιοπολικός δεσμός παρατηρείται στο διοξείδιο του άνθρακα ή στο CO2. Οι δεσμοί σχηματίζονται από τα άτομα προκειμένου να είναι λιγότερο αντιδραστικοί και να απολαμβάνουν μεγαλύτερη σταθερότητα.
Για να κατανοήσουμε πώς και γιατί τα άτομα απαιτούν 8 ηλεκτρόνια στο φλοιό σθένους για να είναι σε σταθερή κατάσταση, ας ξεκινήσουμε με την κατανόηση του τρόπου με τον οποίο τα ηλεκτρόνια κατανέμονται σε ένα άτομο.
Πώς κατανέμονται τα ηλεκτρόνια σε ένα άτομο;
Ένα άτομο είναι το μικρότερο σωματίδιο ενός στοιχείου, αλλά μέσα σε αυτό, υπάρχει ένα δικό του σύμπαν. Τα 3 υποατομικά σωματίδια που αποτελούν μέρος αυτού του μικροσκοπικού σύμπαντος είναι τα νετρόνια, τα πρωτόνια και τα ηλεκτρόνια. Τα νετρόνια δεν έχουν καθαρό φορτίο και βρίσκονται στο κέντρο του ατόμου, μαζί με θετικά φορτισμένα πρωτόνια. Τα νετρόνια και τα πρωτόνια μαζί σχηματίζουν τον πυρήνα του ατόμου. Τα ηλεκτρόνια είναι αρνητικά φορτισμένα σωματίδια που κυκλώνουν τον πυρήνα σαν πλανήτες γύρω από τον ήλιο.
Τα ηλεκτρόνια και τα πρωτόνια έλκονται μεταξύ τους από μια ηλεκτρομαγνητική δύναμη — μια φυσική αλληλεπίδραση μεταξύ ηλεκτρικά φορτισμένων σωματιδίων. Επομένως, ο διαχωρισμός των ηλεκτρονίων από τον πυρήνα απαιτεί μεγάλη ποσότητα ενέργειας. Όσο πιο κοντά βρίσκεται το ηλεκτρόνιο στον πυρήνα, τόσο μεγαλύτερη είναι η ενέργεια που απαιτείται για τον διαχωρισμό του.
Τα ηλεκτρόνια περιστρέφονται σε διαφορετικά κελύφη που ονομάζονται K, L, M και N, ξεκινώντας από τον πυρήνα και επεκτείνονται προς τα έξω. Κάθε προοδευτικό φλοιό έχει διαφορετικό ενεργειακό επίπεδο, που αντιστοιχεί σε 1, 2, 3 ή 4. Ο μέγιστος αριθμός ηλεκτρονίων που μπορεί να περιέχει κάθε φλοιός δίνεται ως 2(n2) όπου n αντιστοιχεί στο επίπεδο ενέργειας. Έτσι, το K έχει 2 ηλεκτρόνια [2(1)2=2], το L έχει 8 ηλεκτρόνια, το M έχει 18 ηλεκτρόνια και το N έχει 32 ηλεκτρόνια.
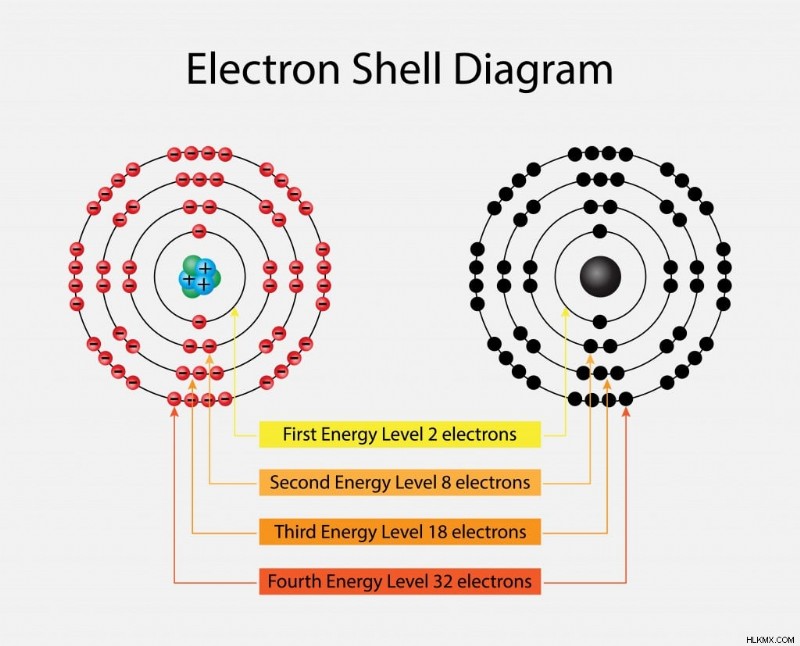
Νέφος ηλεκτρονίων. (Φωτογραφία:Nasky/ Shutterstock)
Επιπλέον, αυτά τα κελύφη χωρίζονται σε υπο-κελύφη που περιέχουν ατομικά τροχιακά. Τα κελύφη περιέχουν τροχιακά που ονομάζονται s, p, d, και f, ξεκινώντας από τον πυρήνα. Η διάταξη των ηλεκτρονίων σε κελύφη και υποκεφάλαια ονομάζεται ηλεκτρονική διαμόρφωση ενός ατόμου.
Ο αριθμός των κελυφών αυξάνεται ανάλογα με τον αριθμό των ηλεκτρονίων που υπάρχουν στο άτομο. Το εξωτερικό περίβλημα του στοιχείου ονομάζεται κέλυφος σθένους και τα ηλεκτρόνια που βρίσκονται εκεί ονομάζονται ηλεκτρόνια σθένους.
Τι είναι τα κελύφη σθένους;
Τα ηλεκτρόνια σθένους συμβάλλουν στην τάση ενός ατόμου να συμμετέχει σε χημικές αντιδράσεις. Ένα άτομο με κλειστό περίβλημα, που περιέχει 8 ηλεκτρόνια στη στιβάδα του σθένους, θεωρείται χημικά αδρανές, καθώς σχεδόν δεν συμμετέχει σε χημικές αντιδράσεις. Τα άτομα τέτοιων στοιχείων θα έχουν τότε μια ηλεκτρονική διαμόρφωση παρόμοια με αυτή των ευγενών αερίων.
Ο περιοδικός πίνακας είναι μια διάταξη πίνακα που περιέχει όλα τα γνωστά στοιχεία ταξινομημένα με βάση την ηλεκτρονική τους διαμόρφωση, τη φύση και τον ατομικό τους αριθμό. Στο δεξιό άκρο του πίνακα βρίσκεται η ομάδα στοιχείων που ονομάζονται ευγενή αέρια. Θεωρούνται σταθερά, καθώς έχουν ένα εντελώς γεμάτο κέλυφος σθένους. Τα 8 ευγενή αέρια είναι το Ήλιο (2), το Νέον (10), το Αργό (18), το Κρυπτόν (36), το Ξένον (54) και το ραδιενεργό στοιχείο Ραδόνιο (86). Κάθε παρένθεση περιέχει τον ατομικό αριθμό του ατόμου.
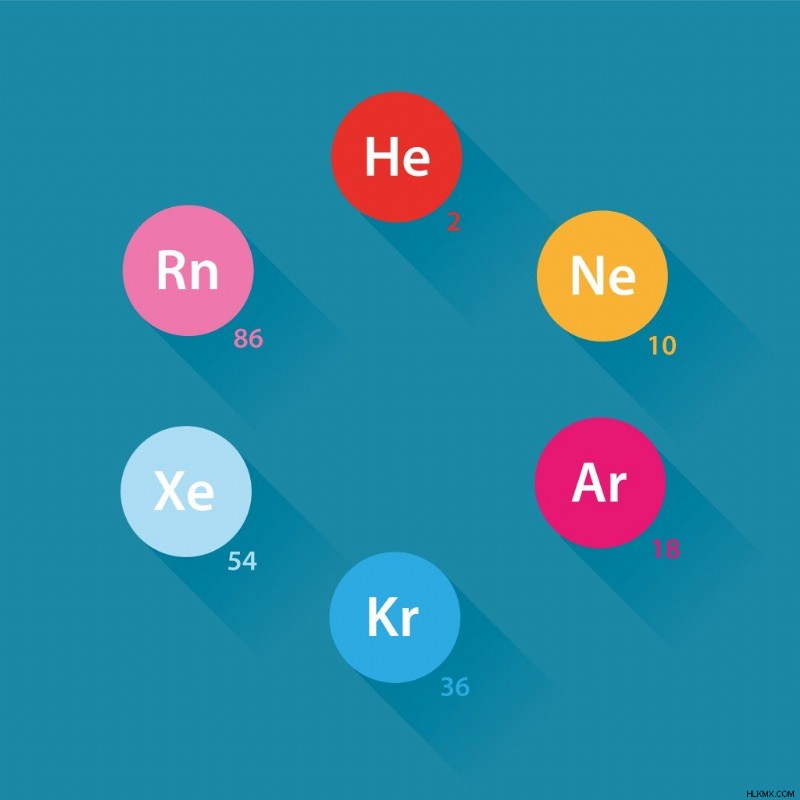
Ευγενή αέρια. (Φωτογραφία :Daumier/Shutterstock)
Τα ευγενή αέρια είναι τα λιγότερο αντιδραστικά επειδή τα εξωτερικά τους επίπεδα ενέργειας είναι ήδη γεμάτα. Η παρουσία 8 ηλεκτρονίων στο εξωτερικό τους περίβλημα κάνει το σθένος των ευγενών αερίων μηδενικό. Άλλα αντιδρώντα άτομα τείνουν να γεμίζουν το εξωτερικό τους περίβλημα με 8 ηλεκτρόνια ακολουθώντας τον κανόνα της οκτάδας προκειμένου να προσεγγίσουν τη σταθερότητα ενός ευγενούς αερίου.
Ο κανόνας της οκτάδας λαμβάνει υπόψη μόνο εκείνα τα ηλεκτρόνια που υπάρχουν στα s και p υποκοχύλια. Αυτά τα δευτερεύοντα κελύφη μπορούν να χωρέσουν έως και 8 ηλεκτρόνια στο εξωτερικό τους κέλυφος.
Μπορείτε να θεωρήσετε ότι τα ηλεκτρόνια σθένους είναι μερικά από τα πιο σημαντικά ηλεκτρόνια που διαθέτει ένα άτομο, καθώς είναι τα ηλεκτρόνια που βρίσκονται στο υψηλότερο ενεργειακό επίπεδο. Αυτά είναι τα ηλεκτρόνια που εμπλέκονται συχνότερα σε χημικές αντιδράσεις. Τα ηλεκτρόνια σθένους μπορούν να μετρηθούν χρησιμοποιώντας τη δομή κουκίδων ηλεκτρονίων Lewis.
Τι είναι η δομή ηλεκτρονίων Lewis (LEDS);
Η δομή Lewis πήρε το όνομά της από τον Gilbert N. Lewis, ο οποίος εισήγαγε για πρώτη φορά την έννοια στο άρθρο του, «The Atom and the Molecule» το 1916. Οι δομές Lewis αντιπροσωπεύουν μόνο τα ηλεκτρόνια σθένους, τα οποία προσδιορίζονται ως κουκκίδες γύρω από το άτομο, κάθε κουκκίδα αντιπροσωπεύει ένα ηλεκτρόνιο σθένους. Τις περισσότερες φορές, άτομα με λιγότερα από 8 ηλεκτρόνια στο κέλυφος σθένους προτιμούν να σχηματίζουν ενώσεις είτε με ομοιοπολικό είτε με ιοντικό δεσμό.
Ο σχηματισμός τέτοιων δεσμών μπορεί να ικανοποιήσει τον κανόνα της οκτάδας. Τα στοιχεία της δεύτερης ομάδας του περιοδικού πίνακα πληρούν τα κριτήρια για 8 ηλεκτρόνια χάνοντας, κερδίζοντας ή μοιράζοντας ηλεκτρόνια μεταξύ των ατόμων.
Ο τύπος του δεσμού που σχηματίζεται εξαρτάται από τον αριθμό των ηλεκτρονίων στο κέλυφος σθένους, καθώς και από τη συνολική ενέργεια που απαιτείται για το σχηματισμό του δεσμού. Τα LED μας βοηθούν να προσδιορίσουμε πόσα ελεύθερα ηλεκτρόνια είναι διαθέσιμα για μια χημική αντίδραση.
Τι είναι ο ομοιοπολικός δεσμός;
Ένας ομοιοπολικός δεσμός είναι μια σύνδεση μεταξύ 2 ατόμων που επιτρέπει την κοινή χρήση ηλεκτρονίων μεταξύ τους, έτσι ώστε κάθε άτομο να έχει μια ηλεκτρονική δομή παρόμοια με αυτή του πλησιέστερου ευγενούς αερίου.
Πάρτε για παράδειγμα το διοξείδιο του άνθρακα:ο άνθρακας και το οξυγόνο έχουν ατομικούς αριθμούς 6 και 8, αντίστοιχα. Ο άνθρακας έχει 2 φλοιούς, K και L, με 2 ηλεκτρόνια στο φλοιό Κ, αφήνοντας 4 ηλεκτρόνια στο κέλυφος L. Για να επιτευχθεί σταθερότητα, ο άνθρακας μπορεί είτε να χάσει και τα 4 ηλεκτρόνια και να είναι πιο κοντά στο ήλιο, είτε να αποκτήσει 4 ηλεκτρόνια και να είναι πιο κοντά στο νέον. Η ενέργεια που απαιτείται για την απόκτηση ή απώλεια 4 ηλεκτρονίων είναι τεράστια, λόγω της ελκτικής δύναμης μεταξύ πρωτονίων και ηλεκτρονίων στον πυρήνα. Ωστόσο, η μέση επιλογή είναι να μοιραστείτε τα ηλεκτρόνια του.
Ομοίως, το οξυγόνο έχει 2 ηλεκτρόνια στο κέλυφος Κ και 6 ηλεκτρόνια στο κέλυφος L. Χρειάζεται μόνο 2 ηλεκτρόνια για να είναι σταθερό και να αποκτήσει ηλεκτρονική διαμόρφωση παρόμοια με το νέον. Η απόκτηση 2 ηλεκτρονίων είναι ευκολότερη από την απώλεια 4 ηλεκτρονίων (πράγμα που θα το έκανε παρόμοιο με το ήλιο). Ως προσαρμογή, 2 άτομα οξυγόνου προτιμούν να μοιράζονται τα ηλεκτρόνια τους με ένα μόνο άτομο άνθρακα, έτσι ώστε και τα τρία να έχουν 8 ηλεκτρόνια στο κέλυφος σθένους και να είναι το καθένα ξεχωριστά σταθερό.
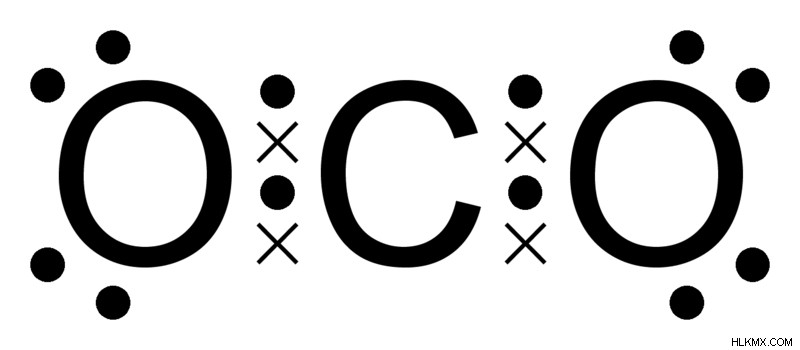
Μια δομή κουκίδων Lewis που δείχνει CO2. Το x αντιπροσωπεύει τα ηλεκτρόνια του άνθρακα και οι τελείες τα ηλεκτρόνια του οξυγόνου. (Φωτογραφία:Ben Mills /Wikimedia Commons)
Το αποτέλεσμα είναι ένα μόριο διοξειδίου του άνθρακα με ένα άτομο άνθρακα και 2 άτομα οξυγόνου, με το καθένα ξεχωριστά να έχει 8 ηλεκτρόνια στο κέλυφος σθένους.
Τι είναι ένας ιονικός δεσμός;
Ένας ιονικός δεσμός είναι ένας τύπος χημικού δεσμού που εμφανίζεται μεταξύ αντίθετα φορτισμένων ιόντων. Ένα άτομο μπορεί να είναι είτε θετικά είτε αρνητικά φορτισμένο, ανάλογα με τον αριθμό των πρωτονίων ή των ηλεκτρονίων που έχει το άτομο σε περίσσεια. Ένα ιόν είναι ένα άτομο με καθαρό φορτίο λόγω της απολαβής ή απώλειας ηλεκτρονίων. Έχοντας υπόψη ότι τα ηλεκτρόνια είναι αρνητικά φορτισμένα, εάν ένα άτομο αποκτήσει ένα ηλεκτρόνιο, θα έχει αρνητικό φορτίο, αλλά εάν χάσει ένα ηλεκτρόνιο, θα έχει θετικό φορτίο. Εν ολίγοις, ένα ιόν είναι ένα άτομο που περιέχει ένα συγκεκριμένο φορτίο.
Ένας ιοντικός δεσμός εμφανίζεται μεταξύ μετάλλων και μη μετάλλων, όπου το ένα είναι ηλεκτροθετικό και το άλλο ηλεκτραρνητικό. Τα ηλεκτροθετικά μέταλλα χάνουν ένα ηλεκτρόνιο για να γίνουν θετικό ιόν, που ονομάζεται κατιόν, ενώ τα ηλεκτραρνητικά μη μέταλλα δέχονται ένα ηλεκτρόνιο και γίνονται ένα αρνητικά φορτισμένο ιόν, που ονομάζεται ανιόν. Η απώλεια και η αποδοχή ηλεκτρονίων είναι η ίδια για να σχηματιστεί ένας ιοντικός δεσμός και ταυτόχρονα κάθε άτομο ικανοποιεί τον κανόνα της οκτάδας!
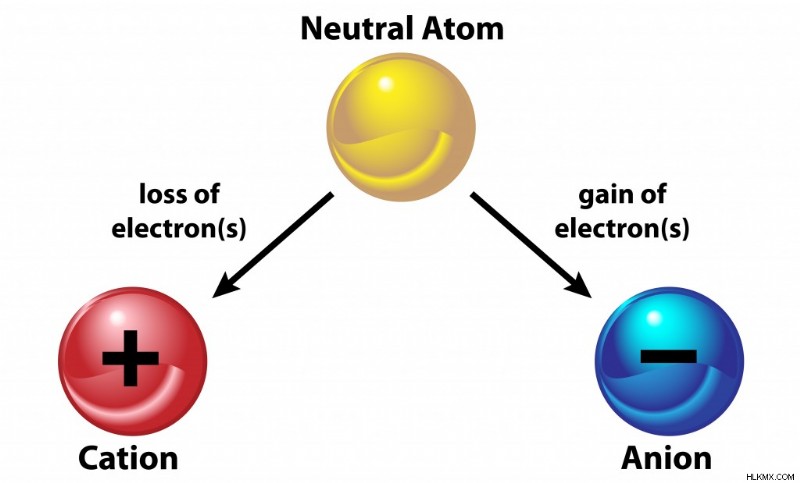
Κατιόν και ανιόν. (Φωτογραφία:OSweetNature/Shutterstock)
Έτσι, όταν ένα άτομο έχει άνισο αριθμό ηλεκτρονίων και πρωτονίων, ονομάζεται ιόν. Ως αποτέλεσμα, 2 άτομα με άνισα φορτία ενώνονται είτε χάνοντας είτε κερδίζοντας τα ηλεκτρόνια τους, επιτυγχάνοντας έτσι ένα ουδέτερο φορτίο μέσω ενός ιοντικού δεσμού. Παραμένουν δεμένα με τη βοήθεια των ελκτικών δυνάμεων μεταξύ τους. Το καθαρό αποτέλεσμα είναι ότι κάθε άτομο είναι σταθερό, καθώς έχει ένα πλήρως γεμάτο κέλυφος σθένους με 8 ηλεκτρόνια.
Το αλάτι ή το χλωριούχο νάτριο είναι ένα εξαιρετικό παράδειγμα ιοντικού δεσμού. Το νάτριο έχει ατομικό αριθμό 11 με 2, 8 και 1 ηλεκτρόνια στα κελύφη K, L και M, αντίστοιχα. Αυτό αφήνει 1 ηλεκτρόνιο στο κέλυφος σθένους, το οποίο το άτομο νατρίου χάνει εύκολα κατά τη διάρκεια μιας αντίδρασης. Το χλώριο έχει ατομικό αριθμό 17 με 2, 8 και 7 ηλεκτρόνια στα κελύφη K, L και M. Το χλώριο έχει 7 ηλεκτρόνια στο κέλυφος σθένους, καθιστώντας το εξαιρετικά ηλεκτραρνητικό. Κάθε άτομο χρειάζεται απλώς να προσαρμόσει 1 ηλεκτρόνιο για να έχει ένα πλήρως γεμάτο κέλυφος σθένους και να αποκτήσει μια διαμόρφωση παρόμοια με το πλησιέστερο ευγενές αέριο.
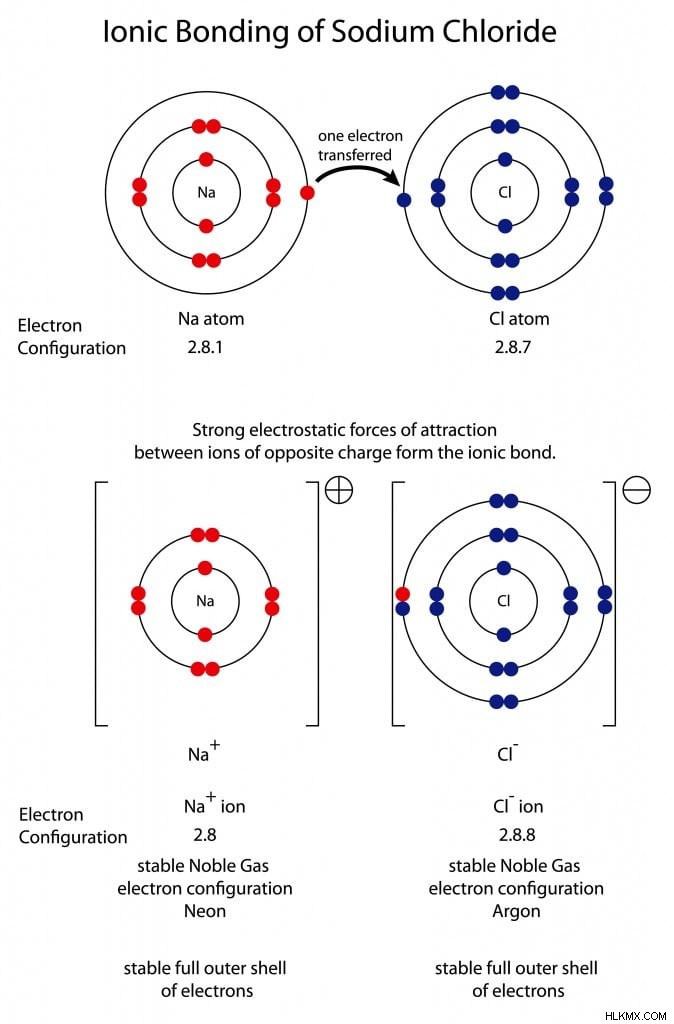
Ιοντικός δεσμός σε χλωριούχο νάτριο (άλας). (Φωτογραφία:Steve Cymro/Shutterstock)
Η ενέργεια που απαιτείται είτε για να αποκτηθούν είτε να χαθούν 7 ηλεκτρόνια, στην περίπτωση του νατρίου ή του χλωρίου, είναι τεράστια. Για να διευκολυνθεί η διαδικασία, το νάτριο χάνει το μοναδικό του ηλεκτρόνιο και αποκτά μια διαμόρφωση ηλεκτρονίων παρόμοια με το νέον (10). Το χλώριο δέχεται το ηλεκτρόνιο που χάνεται από το νάτριο και επιτυγχάνει μια διαμόρφωση ηλεκτρονίων παρόμοια με το αργό (18). Το τελικό αποτέλεσμα είναι ένας ιοντικός δεσμός μεταξύ νατρίου και χλωρίου, που μας δίνει αλάτι.
Στοιχηματίζω ότι ποτέ δεν σκεφτήκατε ότι το βασικό επιτραπέζιο αλάτι θα μπορούσε να έχει τόσο περίπλοκη χημική ιστορία!
Ποιες είναι οι εξαιρέσεις στον κανόνα της οκτάδας;
Υπάρχει πάντα ένα παιδί στην τάξη που του αρέσει να παραβιάζει τους κανόνες και το ίδιο ισχύει και στη χημεία… υπάρχουν μερικά παραδείγματα στοιχείων που δεν ακολουθούν τον κανόνα της οκτάδας. Ας τους ρίξουμε μια σύντομη ματιά.
Τα μόρια με περιττό αριθμό ηλεκτρονίων γενικά δεν ακολουθούν τον κανόνα της οκτάδας. Επίσης, άτομα με μόνο 2 ηλεκτρόνια (συνολικά) εμπίπτουν σε αυτήν την κατηγορία.
Τα άτομα υδρογόνου, με ατομικό αριθμό 1, μπορούν να χωρέσουν το πολύ 2 ηλεκτρόνια, αλλά αυτά τα άτομα έχουν μόνο ένα κέλυφος ηλεκτρονίων με s τροχιάς. Καθώς ο κανόνας της οκτάδας ισχύει για τα s και p μόνο τροχιακά, άτομα με 2 ηλεκτρόνια αποτελούν εξαιρέσεις στον κανόνα.
Τέλος, εξαιρούνται επίσης μόρια στα οποία ένα ή περισσότερα άτομα έχουν περισσότερα ή λιγότερα από 8 ηλεκτρόνια.
Ο κανόνας της οκτάδας είναι ένας από τους πιο σημαντικούς κανόνες στη χημεία και διέπει τον τρόπο με τον οποίο τα άτομα αντιδρούν μεταξύ τους για να συγκρατήσουν 8 ηλεκτρόνια στο κέλυφος σθένους τους. Ο σχηματισμός ομοιοπολικών ή ιοντικών δεσμών είναι ο πιο βολικός τρόπος για τα άτομα να ικανοποιήσουν τον κανόνα της οκτάδας. Εξάλλου, τα άτομα πιθανότατα κουράζονται να αντιδρούν συνεχώς και ακολουθούν τον κανόνα της οκτάδας μόνο και μόνο για να έχουν λίγη ειρήνη και σταθερότητα!




