Γιατί η σκουριά είναι κακός αγωγός του ηλεκτρισμού;
Η σκουριά είναι κακός αγωγός του ηλεκτρισμού επειδή είναι μια ιοντική ένωση στην οποία τα ιόντα δεν κινούνται ελεύθερα.
Εάν έχετε χρησιμοποιήσει ποτέ παλιές μπαταρίες για να τροφοδοτήσετε μια συσκευή, μπορεί να έχετε παρατηρήσει ότι δεν τροφοδοτούν πάντα επαρκώς το αντικείμενο. Σε πιο προσεκτική εξέταση, μπορεί να βρείτε ακόμη και πορτοκαλοκόκκινες νιφάδες που καλύπτουν τους ακροδέκτες. Αφού αφαιρέσετε αυτές τις νιφάδες, η συσκευή θα πρέπει να λειτουργεί κανονικά.
Ωστόσο, γιατί αναπτύχθηκαν αυτές οι νιφάδες στο στοιχείο και γιατί η μπαταρία δεν παρείχε επαρκή ισχύ πριν αφαιρέσετε τις νιφάδες;

Οι σκουριασμένοι ακροδέκτες μπορεί να οδηγήσουν σε ανοιχτό κύκλωμα. (Φωτογραφία :twenty20)
Ο κλάδος της επιστήμης που απαντά σε αυτά τα ερωτήματα είναι η eηλεκτροχημεία .
Μια λέξη για τη διαγωγή
Η ιδιότητα της ύλης που επιτρέπει μια κατευθυντική ροή φορέων ηλεκτρικού φορτίου λόγω της εφαρμογής διαφοράς δυναμικού ονομάζεται ηλεκτρική αγωγιμότητα . Αυτή η κατευθυντική ροή των φορέων φορτίου με το χρόνο ονομάζεται ηλεκτρικό ρεύμα . Η αγωγιμότητα είναι μια εγγενής ιδιότητα (ανάλογα μόνο με την εσωτερική της δομή) και ποσοτικοποιείται ως εξής:
Αγωγιμότητα ενός υλικού,  , είναι το ρεύμα που ρέει μέσω ενός 1 μ μεγάλο δείγμα που είναι 1 m2 κατά διατομή όταν εφαρμόζεται τάση μονάδας (1 volt). Μαθηματικά, η σχέση εκφράζεται ως εξής:
, είναι το ρεύμα που ρέει μέσω ενός 1 μ μεγάλο δείγμα που είναι 1 m2 κατά διατομή όταν εφαρμόζεται τάση μονάδας (1 volt). Μαθηματικά, η σχέση εκφράζεται ως εξής:
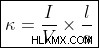 όπου,
όπου,
Εγώ =Ρεύμα (μετριέται ως έξοδος)
V =Εφαρμοσμένη τάση (είσοδος)
l =μήκος δείγματος
a =εμβαδόν διατομής
Δεδομένου ότι η αγωγιμότητα είναι ένα μέτρο της ροής των φορτίων, μόνο εκείνα τα υλικά που περιέχουν ελεύθερους φορείς φορτίου (ιόντα, ηλεκτρόνια, πρωτόνια) μπορούν να μεταφέρουν ηλεκτρισμό.
Χημεία της σκουριάς
Η σκουριά είναι το χημικό προϊόν μιας αντίδρασης οξειδοαναγωγής μεταξύ μεταλλικού σιδήρου και οξυγόνου παρουσία νερού, το οποίο δρα ως καταλύτης (επιταχύνει την ταχύτητα της αντίδρασης). Ο σίδηρος οξειδώνεται σε διάφορα οξείδια σιδήρου, τα οποία έχουν χρώμα από πορτοκαλί-καφέ έως κόκκινο. Σκουριά είναι το γενικό όνομα που αναφέρεται σε όλα αυτά τα οξείδια και τα υδροξείδια του σιδήρου .
Χημική αντίδραση σκουριάς
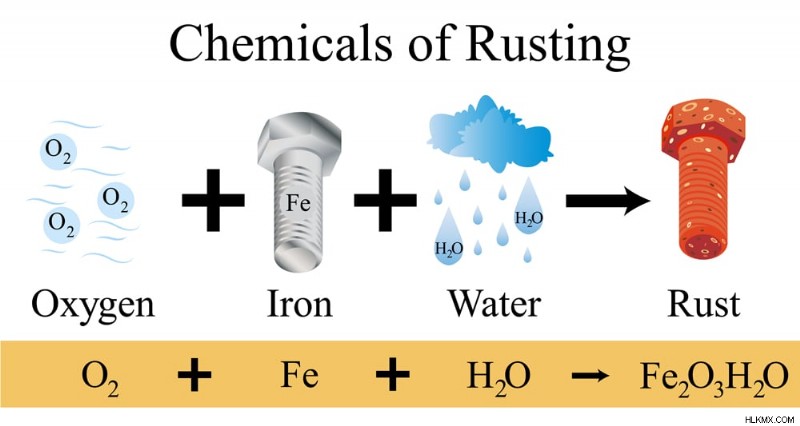
Χημική αντίδραση σκουριάς. (Φωτογραφία:Sansanorth/Shutterstock)
Η αντίδραση για το σχηματισμό σκουριάς αποτελείται από διάφορες υπο-αντιδράσεις που υπαγορεύουν την ταχύτητα της αντίδρασης και το σχηματισμό σκουριάς. Αυτή είναι μια αντίδραση οξειδοαναγωγής όπου ο σίδηρος οξειδώνεται και το οξυγόνο μειώνεται. Τα αντιδρώντα που εμπλέκονται είναι ο μεταλλικός σίδηρος (Fe ), Αέριο οξυγόνο από την ατμόσφαιρα (O2 ) και υδρατμούς/υγρασία (H2O ).
- Φε (s ) ——> Fe2+ (aq ) + 2e– :Σε αυτό το βήμα, ο στερεός σίδηρος χάνει δύο ηλεκτρόνια (οξειδώνεται) παρουσία υγρασίας
- 4Fe2+ (aq ) + O 2 ——> 4Fe3+ + 2O2- :Περαιτέρω οξείδωση του Fe2+ συμβαίνει λόγω παρουσίας ατμοσφαιρικού οξυγόνου
- O2 + 4 e− + 2H2O ——> 4 OH− :Τα ηλεκτρόνια που απελευθερώνονται από την οξείδωση του Fe μειώστε το οξυγόνο σε OH–
- Fe2+ + 2H2O ⇌ Fe(OH)2 + 2H+ :Fe2+ Τα ιόντα στο νερό ενυδατώνονται σε Fe(OH)2
- Fe3+ + 3H2O ⇌ Fe(OH)3 + 3 H+ :Fe3+ Τα ιόντα στο νερό ενυδατώνονται σε Fe(OH)3
- Fe(OH)2 ——> FeO + H2O :Όταν αφαιρείται το νερό (αφυδάτωση), σχηματίζονται FeO και Fe2O3
- 2FeO ——> Fe2O3 + H2O
Η σκουριά είναι ο γενικός όρος για το Fe(OH)2 , Fe(OH)3 , FeO, Fe2O3 και ανώτερα οξείδια και υδροξείδια του σιδήρου.
Φύση χημικών δεσμών
Θυμηθείτε ότι η αγωγιμότητα είναι μια ιδιότητα που προκύπτει από τη διατεταγμένη κίνηση των φορέων φορτίου λόγω τάσης. Οι φορείς φορτίου μπορεί να είναι ιόντα, ηλεκτρόνια ή πρωτόνια. Εάν δεν υπάρχουν φορείς δωρεάν φόρτισης, τότε δεν θα ρέει ρεύμα κατά την εφαρμογή τάσης.
Σχετικά με τον Ιωνικό Δεσμό
Fe(OH)2 , Fe(OH)3 , FeO και Fe2O 3 είναι όλες ιοντικές ενώσεις. Οι ιοντικές ενώσεις σχηματίζονται όταν ένα άτομο μετάλλου (Fe) δωρίζει ηλεκτρόνια σε ένα άτομο μη μετάλλου. Το άτομο μετάλλου αποκτά θετικό φορτίο και το άτομο μη μετάλλου αρνητικό φορτίο, με αποτέλεσμα το σχηματισμό ιόντων. Αυτό προκαλεί ηλεκτροστατική έλξη μεταξύ των δύο αντίθετα φορτισμένων ιόντων. Αυτή η έλξη κρατά τα ιόντα κοντά, και αυτός ο δεσμός ονομάζεται ιονικός δεσμός. Οι ενώσεις που σχηματίζονται λόγω της μεταφοράς ηλεκτρονίων από ένα μέταλλο σε ένα μη μέταλλο ονομάζονται ιοντικές ενώσεις.
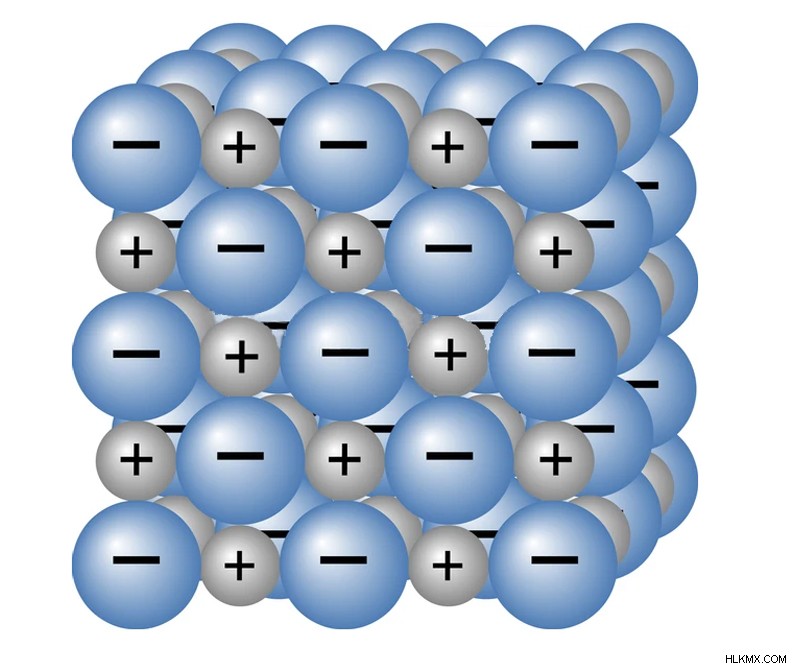
Η ηλεκτροστατική δύναμη έλξης μεταξύ των ιόντων είναι αρκετά ισχυρή ώστε να τα διατηρεί στερεά σε θερμοκρασίες δωματίου. (Φωτογραφία:OSweetNature/Shutterstock)
Γιατί το Rust είναι μονωτικό;
Όταν τα ιόντα βρίσκονται σε υδατικό διάλυμα, τηγμένη ή αέρια μορφή, κινούνται ελεύθερα, αγώγοντας έτσι ηλεκτρισμό. Ωστόσο, όταν βρίσκονται σε στερεά φάση, τα ιόντα δεν είναι ελεύθερα να κινούνται, και αντίθετα συνδέονται ισχυρά μεταξύ τους για να σχηματίσουν κρυστάλλους. Η τάση των ιόντων/φορέων φορτίου να κινούνται παρουσία τάσης ονομάζεται κινητικότητα.
Εφόσον η αγωγιμότητα προκύπτει λόγω της κίνησης των φορέων φορτίου, υπάρχει κάποια χαρακτηριστική ταχύτητα, που ονομάζεται ταχύτητα μετατόπισης, Vd , με το οποίο κινούνται οι φορείς φόρτισης. Όσο μεγαλύτερη είναι η ταχύτητα μετατόπισης, τόσο μεγαλύτερο είναι το ρεύμα. Επίσης, μια τάση παράγει ένα ηλεκτρικό πεδίο, E . Η κινητικότητα ορίζεται ως Vd και E ως:
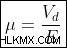
Δεδομένου ότι τα ιόντα δεν κινούνται ελεύθερα στους στερεούς κρυστάλλους, η σκουριά δεν μπορεί να μεταφέρει ηλεκτρισμό!