Zwitterion – Ορισμός, Ιδιότητες, Δομή και Εφαρμογές
Το όνομα "Zwitterion" προέρχεται από τον γερμανικό όρο "zwitter", ο οποίος είναι περίπου συγκρίσιμος με τον "ερμαφρόδιτο" ή "υβρίδιο". Ένα αμφιτεριόν έχει δύο λειτουργικές ομάδες. Μεταφέρουν τόσο θετικά όσο και αρνητικά φορτισμένα ηλεκτρικά ιόντα. Κατά συνέπεια, τα αμφιτεριόντα είναι σε μεγάλο βαθμό ηλεκτρικά ουδέτερα (το καθαρό επίσημο φορτίο τους είναι γενικά μηδέν). Τα "εσωτερικά άλατα" είναι ένα άλλο όνομα για τα αμφιτεριόντα. Οι διπολικές ενώσεις τυπικά δεν κατηγοριοποιούνται ως αμφιτεριόντα. Η μόνη διαφορά είναι ότι τα θετικά και αρνητικά σημάδια στο αμινοξείδιο χρησιμοποιούνται για να υποδείξουν τυπικά φορτία. Τα Zwitterions μπορεί να αξίζει να ληφθούν υπόψη στον φαρμακολογικό σχεδιασμό όταν εργάζεστε με όξινα, βασικά ή ουδέτερα καλώδια.
Ορισμός Zwitterion
Τι είναι το zwitterion; "Ένα αμφιτεριόν μπορεί να οριστεί ως ένα μόριο με θετικές και αρνητικές περιοχές φορτίου." Σε στερεά μορφή, τα αμινοξέα αμφιτεριόντων παραμένουν ως διπολικά ιόντα. Όταν εξετάζουμε εάν μια ένωση είναι αμφιτεριονική, είναι σημαντικό να προσδιορίζεται το εύρος του pH εντός του οποίου απαιτούνται τα δεδομένα (καθώς ένα σωστά αλκαλικό διάλυμα θα μετατρέψει το αμφιτεριόν σε ανιόν και ένα σωστά όξινο διάλυμα θα το μετατρέψει σε κατιόν). /P>
Ακολουθεί μια λίστα με πολλές ιδιότητες διπολικών:-
- Τα αμφιτεριόντα είναι χημικές ενώσεις με θετικά και αρνητικά φορτισμένα ιόντα, όπως ομάδες οξέων ή βάσεων. Οι αμφολύτες είναι ένα κοινό παράδειγμα μιας ένωσης με όξινες και βασικές ομάδες.
- Τα άτομα με ομοιοπολικό δεσμό συγκρατούν τα θετικά και αρνητικά φορτισμένα ιόντα μαζί σε αμφιτεριόντα.
- Δεδομένου ότι αυτές οι ενώσεις διαθέτουν τόσο θετικά όσο και αρνητικά φορτισμένα ηλεκτρικά ιόντα, είναι επίσης σταθερές λόγω των μοναδιαίων ηλεκτρικών φορτίων που διατηρούνται μακριά από τα άτομα.
- Τα περισσότερα αμφιτεριόντα, όπως αυτά που παράγονται από οξέα αμμωνίου, έχουν κατιόντα αμμωνίου.
Αμινοξύ Zwitterion
Τα αμινοξέα είναι τα θεμελιώδη δομικά στοιχεία των πρωτεϊνών σε όλα τα ζωντανά κύτταρα. Είναι ενώσεις που αποτελούνται τόσο από καρβοξυλικές όσο και από αμινομάδες. Οι πρωτεΐνες περιλαμβάνουν είκοσι διακριτά αμινοξέα. Έχουν την ίδια δομή, όπου το R σημαίνει οποιαδήποτε από τις 20 πιθανές πλευρικές αλυσίδες σε ένα αμινοξύ.
Η αμινομάδα (-NH3+) απεικονίζει ένα θετικό φορτίο σε ουδέτερα επίπεδα pH, ενώ η ομάδα καρβοξυλίου (COO-) απεικονίζει ένα αρνητικό φορτίο. Ακολουθεί μια εικόνα της γλυκίνης, του πιο βασικού αμινοξέος, στην κατάστασή του αμφιτεριόν:
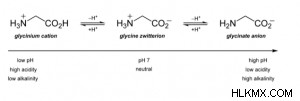
Ένα άλλο ενδιαφέρον χαρακτηριστικό των αμινοξέων αμφιτεριόντων είναι ότι δεν έχουν καθαρό φορτίο εάν το μόριο δεν περιέχει άλλες φορτισμένες ομάδες. Ναι, ένα θετικό φορτίο (+1) και ένα αρνητικό φορτίο (-1) αθροίζονται στο μηδέν (ουδέτερο).
Εκτός από τα αμινοξέα, οποιαδήποτε χημική ένωση που περιέχει κέντρα οξέων και βάσεων μπορεί να δημιουργήσει μια μορφή αμφιτεριόντων. Μερικά από τα παραδείγματά του είναι η δικίνη, η τρικίνη, το στερεό σουλφαμικό οξύ και τα αλκαλοειδή όπως η ψιλοκυβίνη.
Η τιμή του pH επηρεάζει τα χαρακτηριστικά του Zwitterion
Ωστόσο, ένα διπολικό δεν είναι απαραιτήτως αμφισβητούμενο. Αυτές οι ενώσεις έχουν ουδέτερα επίπεδα pH. Οι ομάδες του μπορούν να αποκτήσουν διάφορα φορτία ή να γίνουν ουδέτερες σε επίπεδα pH πάνω ή κάτω από 7. Όταν το pH είναι χαμηλό ή όξινο, τα ιόντα υδρογόνου ενώνονται με την καρβοξυλική ομάδα για να την κάνουν ουδέτερη. Το αμινοξύ έχει τώρα καθαρό φορτίο 1. Η επιπλέον βάση σε υψηλά ή βασικά επίπεδα pH εξαλείφει ένα ιόν υδρογόνου στο Ν, εξουδετερώνοντας την αμινομάδα. Ως αποτέλεσμα, δίνοντας στο αμινοξύ καθαρό φορτίο -1.
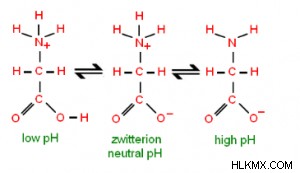
Ισοηλεκτρικό σημείο
- Υπάρχει ένα ισοηλεκτρικό σημείο για κάθε αμφιτεριόν (pI). Το pH όπου ένα αμφιτεριόν είναι αφόρτιστο είναι γνωστό ως ισοηλεκτρικό σημείο. Το pH μπορεί να τροποποιήσει το φορτίο ενός μορίου προσθέτοντας πρωτόνια (H+).
- Δεδομένου ότι η αμινομάδα ενός αμινοξέος λειτουργεί ως ισχυρός δέκτης πρωτονίων, θεωρείται βασική. Η καρβοξυλική ομάδα θεωρείται όξινη και λειτουργεί ως δότης πρωτονίων.
- Το ισοηλεκτρικό σημείο ενός αμφιτεριόντος αμινοξέος μπορεί να προσδιοριστεί με τον μέσο όρο των τιμών pKa των δύο λειτουργικών ομάδων. Η λειτουργική ομάδα καθενός από τα 20 διακριτά αμινοξέα επηρεάζει αυτό (ομάδα R).
- Το μέσο ισοηλεκτρικό σημείο ενός αμινοξέος είναι 5,5 επειδή η μέση pKa της αμινομάδας είναι 9 και η μέση pKa της ομάδας καρβοξυλίου είναι 2. Με άλλους όρους, τα αμινοξέα έχουν τυπικά μηδενικά συνολικά φορτία σε pH 5,5.
Υπολογισμός τιμής pH
Η τιμή του pH στο ισοηλεκτρικό σημείο μπορεί να υπολογιστεί από τις σταθερές ισορροπίας του αμφιτεριόντος (οξέα και βάσεις). Ο τύπος είναι ο εξής:
pI =(pKa1 + pKa2 )/ 2
Πού,
pI =ισοηλεκτρικό σημείο,
Ka1 =η σταθερά ισορροπίας των οξέων.
Ka2 =η σταθερά ισορροπίας των βάσεων.
Εφαρμογή των Zwitterions
Οι αμφιτεριονικές ενώσεις παρουσιάζονται με ίσες ομάδες κατιόντων και ανιόντων στις μοριακές αλυσίδες, γεγονός που τις καθιστά εξαιρετικά υδρόφιλες και αντιρρυπαντικές. Μπορούν να αντέξουν το σχηματισμό βακτηριακής προσκόλλησης, βιοφίλμ και μη ειδική προσρόφηση πρωτεϊνών. Ως εκ τούτου, προσφέρουν μια σημαντική υπόσχεση για χρήση σε πολυάριθμους βιολογικούς και ιατρικά συνδεδεμένους τομείς. Παρακάτω είναι μερικές από τις τυπικές εφαρμογές του:
ΣΕΛΙΔΑ SDS
Τα Zwitterions έχουν πολλές χρήσιμες χρήσεις, αλλά μια από τις πιο διαδεδομένες πρακτικές τεχνικές στη μοριακή βιολογία είναι το SDS PAGE. Αυτή η μέθοδος ηλεκτροφόρησης διαιρεί τα μόρια πρωτεΐνης ανάλογα με το μοριακό τους βάρος. Η γλυκίνη είναι ένα από τα βασικά στοιχεία του μείγματος που χρησιμοποιείται στο SDS PAGE. Τα αμφιτεριονικά χαρακτηριστικά της γλυκίνης είναι ζωτικής σημασίας για αυτήν την προσέγγιση διαχωρισμού πρωτεϊνών. Το pH διαφόρων τμημάτων SDS PAGE ποικίλλει, γεγονός που κάνει τη γλυκίνη στο μείγμα να έχει διαφορετικό φορτίο σε διάφορα σημεία. Η φορτισμένη και η αφόρτιστη γλυκίνη χρησιμοποιείται σε συνδυασμό με ιόντα χλωρίου που υπάρχουν στο διάλυμα για να διασφαλιστεί ότι όλες οι πρωτεΐνες σχηματίζουν συμπυκνωμένες λωρίδες και μετακινούνται κατά μήκος της γέλης ταυτόχρονα.
Διαμφιβτεριονικά πολυμερή (ενώσεις)
Τα μακρά μόρια γνωστά ως αμφιτεριονικά πολυμερή έχουν λειτουργικές ομάδες που είναι τόσο θετικά όσο και αρνητικά φορτισμένες σε κάθε άκρο. Μια βασική εφαρμογή είναι η πρόληψη της ανάπτυξης βιοφίλμ και της μικροβιακής προσκόλλησης μέσω των αντιρρυπαντικών τους δυνατοτήτων. Τα αμφιτεριονικά πολυμερή χρησιμοποιούνται στον θαλάσσιο τομέα για την πρόληψη της ανάπτυξης υποβρύχιων οργανισμών σε σκάφη και προβλήτες. Οι αντιρρυπαντικές δυνατότητες των αμφιτεριονικών πολυμερών είναι χρήσιμες σε δύο τομείς:την ιατρική βιομηχανία, τη διανομή φαρμάκων, τα ιατρικά εμφυτεύματα και τις θαλάσσιες βιομηχανίες, για την πρόληψη της συσσώρευσης υποβρύχιων οργανισμών σε σκάφη και αποβάθρες.
Χρήσεις στην Ιατρική
Εκτός από τις ισχυρές αντιρρυπαντικές τους ιδιότητες, τα αμφιτεριονικά υλικά έχουν και άλλα πλεονεκτήματα. Μπορούν να αυξήσουν τη βιοσυμβατότητα, να μειώσουν τις ανοσολογικές αντιδράσεις, να παρατείνουν τον χρόνο κυκλοφορίας και να επιτρέψουν την κυτταρική πρόσληψη παραδοσιακών χημικών φαρμάκων και θεραπευτικών γονιδίων.
Πληροφοριακές λεπτομέρειεςΛόγω των καλά καθορισμένων μετασχηματισμών φάσης σε υδατικό διάλυμα, των αμφιτεριονικών ιδιοτήτων και των πιθανών χρήσεων ως ανταλλαγής ιόντων, συμπλοκοποιητικών υλικών, καταλυτών, ενσωματωμένων φαρμάκων και αίματος, μακροκύκλων, σταθεροποίησης πρωτεϊνών, καθώς και ηλεκτρονικών εφαρμογών, τα αμφιτεριονικά πολυμερή αποτελούν το επίκεντρο των τόσο πιθανή εφαρμογή όσο και θεμελιώδη επιστημονικά πειράματα. |
Άλλα παραδείγματα Zwitterions
Η πλειοψηφία των ατόμων εξετάζει πρώτα τα αμινοξέα όταν μιλούν για αμφιτεριόντα. Ωστόσο, άλλες ενώσεις μπορούν επίσης να έχουν την ίδια δομή διπολικών ιόντων με τα αμινοξέα. Σουλφαμικό οξύ (NH3 SO3 ) δεν αναγνωρίζεται τόσο καλά όσο το θειικό οξύ (H2 SO4 ) και θειικό οξύ (H2 SO3 ). Χρησιμοποιείται σε προϊόντα καθαρισμού ως υποκατάστατο του υδροχλωρικού οξέος επειδή είναι αποτελεσματικό στην εξάλειψη του ασβέστη και της σκουριάς. Όπως τα αμινοξέα αμφιτεριόντων, το άζωτο έχει φορτίο + και το οξυγόνο έχει φορτίο –. Μερικές φορές ένα εξαιρετικά μακρύ μόριο έχει τις ομάδες + και – στο ένα άκρο. Συχνά τις περιέχουν ενώσεις που μοιάζουν με απορρυπαντικά.
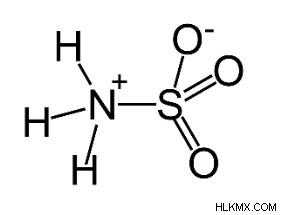
Πράγματα που πρέπει να θυμάστε
- Ένα ενεργό μόριο ομάδας γνωστό ως αμφιτεριόν έχει τουλάχιστον ένα θετικό και αρνητικό ηλεκτρικό φορτίο.
- Το πιο κατάλληλο παράδειγμα αμφιτεριόν είναι ένα αμινοξύ.
- Μέσω της ηλεκτροστατικής έλξης με μόρια νερού, τα αμφιτεριόντα δημιουργούν μεγαλύτερο εμπόδιο στην προσρόφηση και ισχυρή ενυδάτωση.
- Τα δισκία δεν ταξιδεύουν σε ηλεκτρικό πεδίο επειδή είναι ηλεκτρικά ουδέτερα.
- Ένα διπολικό ιόν χρησιμοποιείται συχνά όταν τα μόρια πρωτεΐνης διαχωρίζονται χρησιμοποιώντας τη μέθοδο SDS PAGE (ηλεκτροφόρηση γέλης δωδεκυλοθειικού νατρίου-πολυακρυλαμιδίου).
Συμπέρασμα
Τις τελευταίες δεκαετίες, σημαντικοί όγκοι καινοτόμων υλικών έχουν διερευνηθεί και δημιουργηθεί εκτενώς για βιομηχανικές, ηλεκτρικές, βιοτεχνολογικές και βιολογικές εφαρμογές. Μία από αυτές τις ενώσεις που τυγχάνουν τώρα μεγάλης προσοχής στον τομέα των βιοϋλικών είναι τα αμφιτεριονικά πολυμερή λόγω της εξαιρετικής βιοσυμβατότητας, της υδροφιλίας και των αντιρρυπαντικών ικανοτήτων τους. Τα αμφιτερόνια αναφέρονται περιστασιακά ως «εσωτερικά άλατα». Οι διπολικές ουσίες τυπικά δεν θεωρούνται αμφιτεριόντα. Τα θετικά και αρνητικά σημάδια στο αμινοξείδιο δηλώνουν τυπικά φορτία. Τα αμφιτεριόντα είναι χρήσιμα σε βιοφαρμακευτικά ζητήματα όταν έχουμε να κάνουμε με όξινα, βασικά ή ουδέτερα ηλεκτρόδια.
Συχνές ερωτήσεις σχετικά με το zwitterion
Ε1.Τι είναι το αμφιτεριόν;
Α: Ένα ιόν που έχει δύο λειτουργικές ομάδες ονομάζεται αμφιτεριόν. Με απλά λόγια, είναι ένα ιόν που φέρει τόσο θετικά όσο και αρνητικά ηλεκτρικά φορτία. Τα αμφιτεριόντα είναι σε μεγάλο βαθμό ηλεκτρικά ουδέτερα (το καθαρό επίσημο φορτίο είναι ως επί το πλείστον μηδέν). Μερικές φορές, τα αμφιτεριόντα αναφέρονται ως "εσωτερικά άλατα"
Ε2. Τι είναι το αμινοξύ αμφιτεριόν;
Α: Ένα μόριο με θετικά και αρνητικά ιόντα είναι γνωστό ως αμφιτεριόν. Το καρβοξυλικό ιόν παρέχει στο αμφιτεριόν αμινοξύ το αρνητικό του φορτίο και το ιόν αμμωνίου παρέχει το θετικό του φορτίο.
Ε3.Πώς σχηματίζονται τα αμφιτεριόν;
Α: Τα διπολικά ιόντα είναι διπολικά ιόντα που σχηματίζονται με συνδυασμό αμινο και καρβοξυλικών ομάδων. Ως αποτέλεσμα, ένα αμινοξύ αποτελεί την πλειοψηφία του. Σε ένα αμφιτεριόν, η ομάδα αμίνης έχει θετικό φορτίο, ενώ η ομάδα καρβοξυλίου έχει αρνητικό φορτίο
Ε4.Τα αμφισβητούμενα είναι πάντα ουδέτερα;
Α: Λόγω της ηλεκτρικής τους ουδετερότητας, τα αμφιτεριόντα δεν κινούνται σε ηλεκτρικό πεδίο. Σε ένα όξινο μέσο (κάτω από το επίπεδο pH 2), η πιο κοινή μορφή αμινοξέος είναι θετικά φορτισμένη και ρέει προς την κάθοδο.




