Τι είναι οι Περικυκλικές Αντιδράσεις;
Μια περικυκλική αντίδραση αναφέρεται στη συνεχή ροή ηλεκτρονίων με δεσμούς π στην κυκλική μεταβατική κατάσταση. Υπάρχουν τέσσερις τύποι περικυκλικών αντιδράσεων.
Μια χημική αντίδραση είναι η ουσία της χημείας. Δύο ή περισσότερες χημικές ουσίες αντιδρούν μαζί για να παράγουν ένα εντελώς διαφορετικό προϊόν. Στην ανόργανη χημεία, υπάρχουν τέσσερις κύριοι τύποι αντιδράσεων. Αυτές είναι οι αντιδράσεις συνδυασμού, αποσύνθεσης, μονής μετατόπισης και διπλής μετατόπισης.
Ομοίως, στην οργανική χημεία, οι αντιδράσεις ταξινομούνται με βάση τον μηχανισμό τους. Αυτές οι τρεις κατηγορίες είναι Ιονικές, Ριζικές και Περικυκλικές. Μπορεί να έχετε ακούσει για τις άλλες δύο, αλλά τι γίνεται με τις περικυκλικές αντιδράσεις; Πώς συμβαίνουν;
Τι είναι η περικυκλική αντίδραση;
Η λέξη «περί» σημαίνει γύρω, και «κυκλική» σημαίνει κύκλος. Έτσι, μια περικυκλική αντίδραση αναφέρεται στη συνεχή ροή ηλεκτρονίων με π-δεσμούς στην κυκλική μεταβατική κατάσταση (TS). Οι διαδικασίες διάσπασης δεσμού και σχηματισμού δεσμών λαμβάνουν χώρα σε συνεννόηση, χωρίς να σχηματίζουν ενδιάμεσο.
Για να είναι η αντίδραση περικυκλική, είναι απαραίτητο ένα συντονισμένο σύστημα σχηματισμού δεσμών. Η διάσπαση και ο σχηματισμός ομολόγων γίνονται ταυτόχρονα, αλλά όχι απαραίτητα στον ίδιο βαθμό ή με τον ίδιο ρυθμό. Στις περισσότερες περιπτώσεις, οι π-δεσμοί εισέρχονται στην κατάσταση κυκλικής μετάβασης.
Οι περικυκλικές αντιδράσεις ξεκινούν είτε με θερμότητα (θερμική) είτε με φως (φωτογραφία). Αυτές οι αντιδράσεις είναι στερεοειδικές. Η στερεοχημεία του προϊόντος εξαρτάται από τη στερεοχημεία του αντιδραστηρίου. Έτσι, η αντίδραση που ξεκινά από διεργασίες θερμότητας και φωτός θα αποφέρει αποτελέσματα με αντίθετη στερεοχημεία.
Η αντίδραση Diels-Alder είναι ένα ιδανικό παράδειγμα μιας περικυκλικής αντίδρασης. Σε αυτή την αντίδραση, η ακρολεΐνη (διένιο) και ο μεθυλ βινυλαιθέρας (διενόφιλος) αντιδρούν μαζί για να σχηματίσουν γλουταραλδεΰδη. Εδώ, τρεις δεσμοί π σπάνε και σχηματίζουν δύο δεσμούς σ και έναν δεσμό π στο γινόμενο.

Αντίδραση Diels-Adler (Φωτογραφία :Alsosaid1987/Wikimedia commons)
Ποιοι είναι οι τύποι των περικυκλικών αντιδράσεων;
Αν και υπάρχουν τέσσερις βασικοί τύποι περικυκλικών αντιδράσεων, όλοι ακολουθούν το ίδιο χαρακτηριστικό μιας συντονισμένης κυκλικής μετατόπισης ηλεκτρονίων. Οι τύποι των περικυκλικών αντιδράσεων είναι κυκλοπροσθήκες, ηλεκτροκυκλικές αντιδράσεις, σιγματροπικές αναδιατάξεις και ομαδική μεταφορά.
1. Ηλεκτροκυκλική αντίδραση
Σε μια ηλεκτροκυκλική αντίδραση, οι ακροδέκτες του δεσμού π του αντιδρώντος σχηματίζουν έναν δεσμό σ για να ολοκληρώσουν τον δακτύλιο. Αντίθετα, ένας δεσμός σ σπάει για να δημιουργήσει ένα σύστημα ανοιχτού δακτυλίου. Αυτή είναι μια ρετρο-ηλεκτροκυκλική αντίδραση. Όλες οι ηλεκτροκυκλικές αντιδράσεις είναι αναστρέψιμες αντιδράσεις.
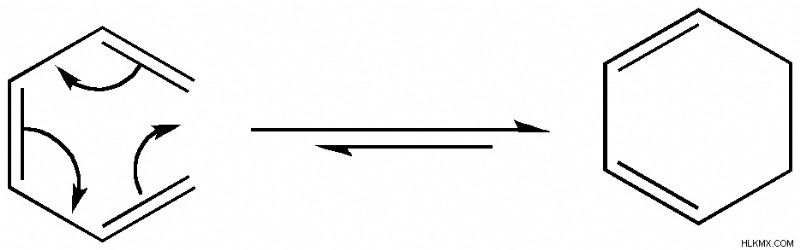
Μια ηλεκτροκυκλική αντίδραση μεταξύ εξαδιενίου και κυκλοεξαδιενίου (Προσφορά φωτογραφίας :Jbogart88/Wikimedia commons)
Με βάση τη στερεοχημεία των αντιδρώντων, το προϊόν του ίδιου συστήματος ηλεκτρονίων μπορεί να διαφέρει στις ηλεκτροκυκλικές αντιδράσεις.
2. Αντίδραση κυκλοπροσθήκης
Στις αντιδράσεις κυκλοπροσθήκης, δύο ή περισσότερα συστατικά με π ηλεκτρόνια αντιδρούν για να σχηματίσουν έναν δακτύλιο. Κάθε αντιδρών χάνει έναν π-δεσμό για να δημιουργήσει δύο νέους δεσμούς σ, οι οποίοι κλείνουν τον δακτύλιο. Το κυκλικό προϊόν που προκύπτει έχει δύο δεσμούς σ και έναν π-δεσμό.
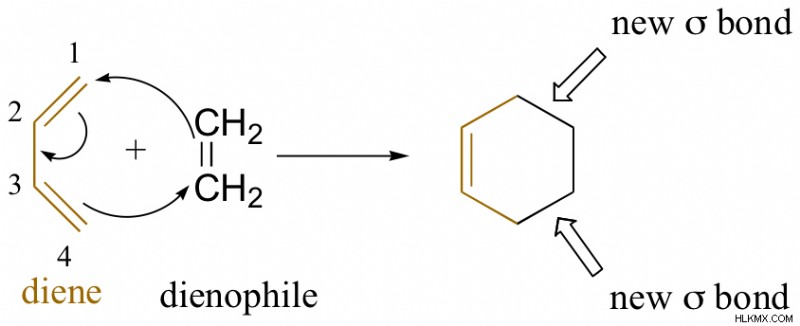
Αντίδραση Diels-Alder μεταξύ βουτα-1,3-διενίου και αιθενίου
Στην παραπάνω αντίδραση, το βουτ-1,3-διένιο (διένιο) αντιδρά με το αιθένιο (διενόφιλο) για την παραγωγή κυκλοεξανίου. Η αντίδραση Diels-Adler είναι μια αντίδραση κυκλοπροσθήκης. Τα αντιδρώντα ενώνονται μέσω μιας κυκλικής μεταβατικής κατάστασης για να σπάσουν τους π-δεσμούς του διενίου και του διενόφιλου και σχηματίζουν δύο δεσμούς σ ταυτόχρονα.
3. Σιγματροπικές αναδιατάξεις
Μια συντονισμένη αναδιάταξη περιλαμβάνει τη μετατόπιση ηλεκτρονίων που συνδέονται με έναν δεσμό σ στο τερματικό ηλεκτρόνιο του δεσμού π. Αυτή η αντίδραση είναι γνωστή ως σιγματροπική αναδιάταξη. Είναι επειδή ο δεσμός σ φαίνεται να κινείται εντός του συστήματος ηλεκτρονίων κατά τη διάρκεια της αντίδρασης. Ο αριθμός των π και σ δεσμών παραμένει αμετάβλητος.
Η αντίδραση χαρακτηρίζεται από το σύστημα διπλών αριθμών, δηλ. [i,j]. Ο πρώτος αριθμός δείχνει την αρχική θέση του δεσμού σ και ο δεύτερος αριθμός υποδηλώνει τη νέα θέση του μεταναστευτικού δεσμού σ. Για παράδειγμα, η [1,5] σιγματροπική αναδιάταξη.
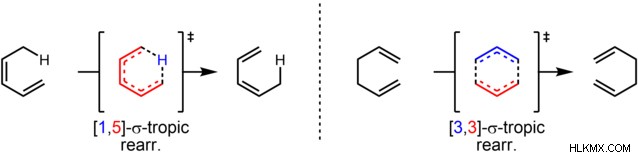
[1,5] σιγματοτροπική αναδιάταξη (Προσφορά φωτογραφίας :Alsosaid1987/Wikimedia commons)
Σε αυτή την αντίδραση, το μεταναστευτικό άτομο που συνδέεται με έναν σ-δεσμό με αλλυλικό άνθρακα έχει αριθμό-1. Το μεταναστευτικό άτομο-1 μετατοπίζεται στο άτομο-5 της αλκενυλικής αλυσίδας. Έτσι, η αντίδραση είναι γνωστή ως [1,5] σιγματροπική αναδιάταξη.
Μια σιγματροπική αναδιάταξη μπορεί να συμβεί με δύο στερεοχημικές διεργασίες. Στην επιφανειακή διαδικασία, ο μεταναστευτικός δεσμός σ μετακινείται προς την ίδια πλευρά του μορίου, ενώ, στην αντιπροσωπική διαδικασία, ο μεταναστευτικός δεσμός σ μετακινείται στην αντίθετη πλευρά του μορίου.
4. Ομαδική μεταφορά
Όπως υποδηλώνει το όνομα, αυτή είναι μια αντίδραση κατά την οποία ένα ή περισσότερα άτομα ή ομάδες μεταφέρονται από το ένα μόριο στο άλλο. Το μόριο συνδέεται με δεσμό σ. Μπορεί να φαίνονται παρόμοια με τις σιγματροπικές αντιδράσεις και τις αντιδράσεις κυκλοπροσθήκης. Ωστόσο, είναι μια διμοριακή αντίδραση και δεν χάνει έναν δεσμό π για να σχηματίσει έναν δακτύλιο μέσω σ-σύνδεσης.
Υπάρχουν δύο είδη αντιδράσεων ομαδικής μεταφοράς:αντιδράσεις ενίου και αναγωγές διιμιδίου. Σε μια αντίδραση ενίου, το αλκένιο που έχει έναν αλλυλικό υδρογονάνθρακα (ένιο) υφίσταται μια θερμική αντίδραση με ένα ενόφιλο. Τα ενόφιλα είναι ενώσεις που περιέχουν πολλαπλούς δεσμούς. Σε αυτήν την αντίδραση, το άτομο υδρογόνου του αλλυλικού άνθρακα μεταναστεύει από το αλκένιο στο ενόφιλο.
Ο π-δεσμός του ενόφιλου αντικαθίσταται από δύο δεσμούς σ με ένα αλκένιο.
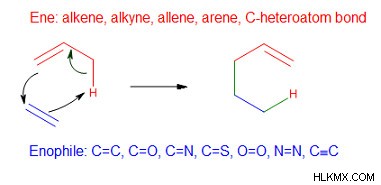
Παράδειγμα αντίδρασης ene (Προστασία φωτογραφίας :Smarandacraciun/Wikimedia commons)
Η αναγωγή διιμιδίου είναι ένας άλλος τύπος αντίδρασης ομαδικής μεταφοράς. Σε αυτή την αντίδραση, ένας ακόρεστος υδρογονάνθρακας ανάγεται για να σχηματίσει ένα αλκάνιο αντιδρώντας με διιμίδιο (H2N2). Κατά τη διάρκεια της αντίδρασης, το διιμίδιο οξειδώνεται για να σχηματίσει άζωτο (N2).
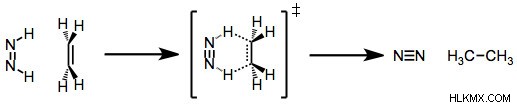
Αντίδραση μείωσης διιμιδίου (Πιστωτική φωτογραφία :OrganicReactions/Wikimedia commons)
Θεωρίες που προβλέπουν τις περικυκλικές αντιδράσεις
Υπάρχουν τρεις κύριες θεωρίες για τον εξορθολογισμό των περικυκλικών αντιδράσεων:Η διατήρηση της τροχιακής συμμετρίας, η μέθοδος Frontier Molecular Orbital (FMO) και η θεωρία Huckel-Mobius (HM).
1. Διατήρηση της τροχιακής συμμετρίας
Το 1965, οι Robert Woodward και Roald Hoffmann πρότειναν την αρχή της Διατήρησης της Τροχιακής Συμμετρίας. Αναφέρει ότι στις συντονισμένες αντιδράσεις, η τροχιακή συμμετρία παρέμεινε διατηρημένη. Αυτό είναι επίσης γνωστό ως κανόνας Woodward-Hoffmann.
2. Θεωρία οριακής μοριακής τροχιάς
Το 1952, ο Kenichi Fukui πρότεινε την Frontier Molecular Orbital Theory (FMO). Επικεντρώνεται στο υψηλότερο κατειλημμένο μοριακό τροχιακό (HOMO) και στο χαμηλότερο μη κατειλημμένο μοριακό τροχιακό (LUMO). Τέτοια μοριακά τροχιακά είναι οριακά μοριακά τροχιακά.
3. Θεωρία Huckel-Mobius (HM)
Η θεωρία λέει ότι σε μια αρωματική μεταβατική κατάσταση, μια περικυκλική αντίδραση λαμβάνει χώρα θερμικά, ενώ η φωτοχημική περικυκλική αντίδραση λαμβάνει χώρα σε μια αντι-αρωματική μεταβατική κατάσταση. Η θεωρία HM είναι επίσης γνωστή ως η θεωρία της διαταραχής μοριακής τροχιάς (PMO).

Συμπέρασμα
Οι περικυκλικές αντιδράσεις έχουν σημαντικό ρόλο σε πολλές διαδικασίες της ζωής. Για παράδειγμα, choismate σε Escherichia coli υφίσταται μια αντίδραση κυκλοπροσθήκης για να σχηματίσει προφαινικό. Μια [1,7]-σιγματροπική αντίδραση εμφανίζεται στην επιδερμίδα για τη σύνθεση της βιταμίνης D. Έτσι, η μελέτη των περικυκλικών αντιδράσεων μπορεί να βελτιώσει την κατανόησή μας για τις βιοχημικές διεργασίες σε διάφορους οργανισμούς.




