Διαλύει ένα ισχυρό οξύ ψυχρές και ζεστές ουσίες σε ίσους ρυθμούς;
Τα ισχυρά οξέα έχουν υψηλή διαλυτική ισχύ, λόγω της υψηλής διηλεκτρικής τους σταθεράς. Ωστόσο, η θερμοκρασία επηρεάζει επίσης το πόσο γρήγορα διαλύεται μια ουσία.
Κάθε φορά που μιλάμε για οξέα, συνήθως υποθέτουμε ότι είναι επικίνδυνα ή επιβλαβή. Ναι, είναι επιβλαβή εάν χρησιμοποιηθούν με λάθος τρόπο, αλλά τα οξέα είναι απαραίτητα, όπως κάθε άλλο χημικό συστατικό στη Γη.
Το στομάχι μας φιλοξενεί ένα ισχυρό οξύ, το HCl (υδροχλωρικό οξύ), χωρίς το οποίο δεν θα μπορούσαμε ποτέ να αφομοιώσουμε την τροφή. Το φυλλικό οξύ που βρίσκεται στα φυλλώδη λαχανικά και φρούτα είναι ένα απαραίτητο απόθεμα βιταμίνης Β. Το ξύδι (οξικό οξύ) κάνει το φαγητό μας πιο νόστιμο. Δεδομένης αυτής της διπλής φύσης των οξέων, είναι ενδιαφέρον να μελετήσουμε τις ιδιότητές τους.
Τι είναι τα ισχυρά οξέα;
Η ισχύς ενός οξέος καθορίζεται συνήθως από την ικανότητά του να δίνει πρωτόνια (H+) όταν διαλύεται σε νερό (οξύ Brønsted). Ως εκ τούτου, υπάρχει μια κλίμακα που ονομάζεται "κλίμακα pH" (το p σημαίνει "potenz," που σημαίνει «δύναμη» στα γερμανικά), που προσδιορίζει την ισχύ ενός οξέος ή μιας βάσης.
Κυμαίνεται από 0 (πιο όξινο) έως 14 (πιο βασικό/αλκαλικό).
Προσδιορίζουμε το pH χρησιμοποιώντας έναν απλό τύπο pH =-log10[H+], όπου [H+] είναι η συγκέντρωση των πρωτονίων που εκφράζεται σε mol/L.
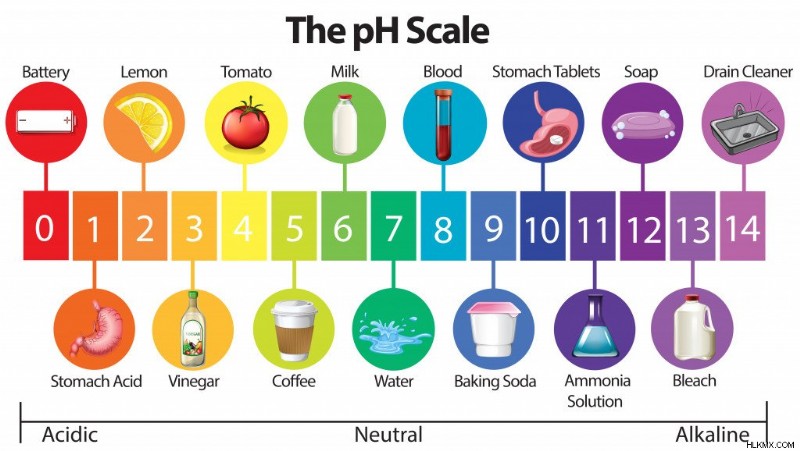
Η κλίμακα pH (Πιστωτική φωτογραφία :BlueRingMedia/Shutterstock)
Έτσι, όταν μιλάμε για ισχυρά οξέα, βρισκόμαστε στην περιοχή pH 0 έως 2. Τα ισχυρά οξέα προσδιορίζονται με βάση την ταχεία δωρεά πρωτονίων και μερικά από αυτά είναι εξαιρετικά διαβρωτικά, όπως HCl, H2SO4, HNO3, πικρινικό οξύ κ.λπ. Στα αδύναμα οξέα περιλαμβάνονται το οξικό οξύ (ξύδι), το κιτρικό οξύ (λεμόνια), το βενζοϊκό οξύ κ. .

Σχετική διαπερατότητα(ε) των Οξέων
Η σχετική διαπερατότητα ονομάζεται επίσης «διηλεκτρική σταθερά» ενός υγρού. Είναι το μέτρο της δύναμης που απαιτείται για να διατηρηθούν χωριστά δύο φορτισμένα σωματίδια. Όσο μεγαλύτερη είναι η τιμή της διηλεκτρικής σταθεράς, τόσο λιγότερη δύναμη θα απαιτείται για να διατηρηθούν τα φορτισμένα σωματίδια διαχωρισμένα. Ο τύπος για τον υπολογισμό της διηλεκτρικής σταθεράς είναι:
εr =ε / ε0
Πού,
ε =Επιτρεπτότητα – Εξαρτάται από τη φύση του μέσου μεταξύ των δύο φορτίων
ε0 =Διαπερατότητα κενού – Μια σταθερά – 8,854 × 10−12 J −1 C2 m−1 .
Η διηλεκτρική σταθερά είναι μια αδιάστατη ποσότητα. Για παράδειγμα, παίρνουμε πάντα τη διηλεκτρική σταθερά ενός κενού ως 1 και αυτή του νερού στους 250 C ως 78, δηλαδή σχεδόν δύο φορές μεγαλύτερη από αυτή του κενού. Αυτό σημαίνει απλώς ότι στο κενό, τα δύο φορτισμένα σωματίδια δεν μπορούν να διαχωριστούν, καθώς το κενό προσφέρει λιγότερη αντίσταση στην ενδοιονική δύναμη, ενώ στο νερό, τα δύο φορτισμένα σωματίδια μπορούν να παραμείνουν ως έχουν και να παραμείνουν σταθερά.
Η διηλεκτρική σταθερά μιας ουσίας είναι πολύ μεγάλη εάν τα συστατικά της μόρια μπορούν εύκολα να πολωθούν. Στο νερό, υπάρχει υψηλή πολικότητα λόγω ενός εξαιρετικά ηλεκτραρνητικού ατόμου οξυγόνου που συνδέεται με ένα ηλεκτροθετικό άτομο υδρογόνου. Αυτό καθιστά το νερό έναν καλό πολικό διαλύτη, γι' αυτό και αποκαλείται συχνά «Παγκόσμιος Διαλύτης».
Όταν μιλάμε για ισχυρά οξέα, υποθέτουμε ότι είναι εξαιρετικά ιονίσιμα, γιατί μόνο τότε μπορούν να δωρίσουν πρωτόνια. Στην πραγματικότητα, τα περισσότερα ισχυρά οξέα έχουν διηλεκτρική σταθερά μεγαλύτερη από το νερό.
| ΟΞΥ | ΘΕΡΜΟΚΡΑΣΙΑ (0C) | ΔΙΗΛΕΚΤΡΙΚΗ ΣΤΑΘΕΡΑ ( εr) |
| Θειικό οξύ (H2SO4) | 20 | 84 |
| Υδροχλωρικό οξύ (HCl) | -95 | 9.3 |
| Νιτρικό οξύ (HNO3) | 14 | 55 |
| Υδροϊωδικό οξύ (HI) | -50 | 3.4 |
Αυτό σημαίνει ότι μια ουσία θα διαλύεται στο οξύ πιο εύκολα από το νερό. Επομένως, τα ισχυρά οξέα είναι ιδιαίτερα διαβρωτικά, καθώς διαλύουν τις ουσίες πολύ γρήγορα. Αυτή η αντίδραση είναι εξαιρετικά εξώθερμη, γεγονός που αυξάνει τη θερμοκρασία.

Επίδραση της θερμοκρασίας στη διαλυτότητα
Το νερό, ως παγκόσμιος διαλύτης, έχει πολλές εφαρμογές σε αντιδράσεις και διεργασίες. Πολλές ουσίες διαλύονται εύκολα στο νερό, ενώ κάποιες απαιτούν θέρμανση για να διαλυθούν. Η ιδέα εδώ είναι «παροχή ενέργειας». όταν παρέχουμε θερμότητα, ουσιαστικά αυξάνουμε την κινητική ενέργεια των διαλυμένων ουσιών. Όταν αποκτούν ενέργεια, η κίνησή τους επιταχύνεται και αποσυντίθεται και στη συνέχεια συμπιέζονται μεταξύ των μορίων του διαλύτη.
Φανταστείτε ότι οι μαθητές κάθονται με τάξη σε μια τάξη ενώ το μάθημα συνεχίζεται. Ξαφνικά, κάποιος φωνάζει ότι υπάρχει φωτιά μέσα στο σχολείο (πηγή θερμότητας). η άμεση αντίδραση των μαθητών θα τρέξει να φύγει από το σχολείο.
Η διασπορά των παιδιών από μια τακτική διάταξη σε μια χαοτική είναι αυτό που συμβαίνει όταν θερμαίνουμε μια διαλυμένη ουσία. Ως εκ τούτου, είναι μια γενική τάση ότι όταν διαλύουμε ένα στερεό στο νερό, με την αύξηση της θερμοκρασίας, η διαλυτότητα αυξάνεται (το αντίστροφο ισχύει για τα αέρια).
Το ίδιο συμβαίνει και με ένα ισχυρό οξύ. Όταν βάζουμε μια καυτή ουσία, παρέχουμε περισσότερη ενέργεια στο οξύ, γεγονός που αυξάνει την ικανότητα ιονισμού, γεγονός που αυξάνει ελαφρώς τη διηλεκτρική του σταθερά. Ως εκ τούτου, το οξύ διαλύει την ουσία πιο γρήγορα, σε σύγκριση με μια ψυχρή ουσία.
Ποιο φαγητό αφομοιώνεται πιο γρήγορα, ζεστό ή κρύο;

Όσον αφορά την εφαρμογή αυτής της έννοιας, θα πρέπει να αναρωτηθούμε:πρέπει να τρώμε ζεστό ή κρύο φαγητό, δεδομένου ότι το στομάχι μας περιέχει ένα πολύ ισχυρό οξύ—HCl; Η κατανάλωση ζεστού φαγητού διευκολύνει την πέψη μας, σε σύγκριση με την κατανάλωση κρύου φαγητού.
Όταν το φαγητό είναι ζεστό, διασπά ορισμένα από τα θρεπτικά συστατικά ή τα κάνει πιο ευαίσθητα στη γρήγορη διάσπαση μέσω του οξέος. Το κρύο φαγητό, από την άλλη πλευρά, θα απαιτούσε περισσότερο χρόνο και ενέργεια για να αναλυθεί.
Ως εκ τούτου, υπάρχει διαφορά στον χρόνο που απαιτείται για την πέψη του ζεστού και του κρύου φαγητού.
Συμπέρασμα
Τα ισχυρά οξέα διαλύουν τις ουσίες εύκολα, ανεξάρτητα από τη φύση τους, λόγω της υψηλής διηλεκτρικής σταθεράς. Οι θερμές ουσίες θα διαλυθούν πιο γρήγορα από τις ψυχρές ουσίες, καθώς έχουν υψηλή θερμική ενέργεια, η οποία βοηθά το οξύ να διαλυθεί γρήγορα, ενώ οι ψυχρές ουσίες θα πάρουν λίγη θερμότητα από το ίδιο το οξύ για να το φέρουν σε θερμοκρασία δωματίου, επιβραδύνοντας έτσι τη διαδικασία διάλυσης.




