Γεγονότα λιθίου
Το λίθιο είναι ο ατομικός αριθμός 3 στον περιοδικό πίνακα με το σύμβολο του στοιχείου Li. Ακολουθεί μια συλλογή στοιχείων για το λίθιο, συμπεριλαμβανομένων των ιδιοτήτων, των χρήσεων και των πηγών του.

Βασικά στοιχεία για το λίθιο
Όνομα: Λίθιο
Ατομικός αριθμός: 3
Σύμβολο στοιχείου: Li
Ομάδα: 1
Περίοδος: 2
Αποκλεισμός: s
Οικογένεια στοιχείων: Αλκαλιμέταλλο
Ατομική μάζα: [6.938; 6.997] Κατευθυντήριες γραμμές IUPAC
Το 6,941 χρησιμοποιείται συνήθως για μια μεμονωμένη τιμή
Διαμόρφωση ηλεκτρονίου: [He]2s (συντομογραφία) ή 1s2s (πλήρης)
Ανακάλυψη: Johan August Arfwedson το 1817.
Ο Arfwedson ανέλυε μετάλλευμα πεταλίτη. Όταν κάηκε, έβγαλε μια λαμπερή κόκκινη φλόγα. Περαιτέρω έρευνα έδειξε ότι περιείχε μια ουσία που δρούσε σαν αλκαλικό μέταλλο αλλά ήταν ελαφρύτερη από το νάτριο. Προσπάθησε να δώσει ένα καθαρό δείγμα του μετάλλου διαχωρίζοντας το μέταλλο χρησιμοποιώντας ηλεκτρόλυση, αλλά δεν τα κατάφερε. Το 1821, ο Άγγλος χημικός William Brande παρήγαγε ένα πολύ μικρό δείγμα καθαρού λιθίου, αλλά όχι αρκετό για να κάνει χρήσιμες μετρήσεις. Λίθιο δεν θα παρήχθη σε μεγάλες ποσότητες μέχρι το 1855 από τον Γερμανό χημικό Robert Bunsen και τον Βρετανό χημικό Augustus Matthiessen.
Προέλευση ονόματος: λίθος (Ελληνικά σημαίνει «πέτρα») Ο Arfwedson ονόμασε το αλκαλικό μέταλλό του από μια πέτρα για να αντικατοπτρίζει την προέλευσή της. Άλλα αλκαλικά μέταλλα όπως το νάτριο και το κάλιο βρίσκονται συνήθως στα φυτά.
Κοινά ισότοπα:
Το λίθιο αποτελείται κυρίως από δύο σταθερά ισότοπα. Ισότοπα που κυμαίνονται από λίθιο-3 έως λίθιο-12 έχουν παραχθεί σε εργαστηριακές συνθήκες.
Li
Το λίθιο-6 είναι ένα σταθερό ισότοπο λιθίου που περιέχει τρία νετρόνια. Το 7,59% του φυσικού λιθίου περιέχει λίθιο-6.
Li
Το λίθιο-7 είναι το πιο κοινό ισότοπο. Περιέχει 4 νετρόνια και αντιπροσωπεύει το 92,41% του συνόλου του φυσικού λιθίου.
Φυσικά δεδομένα

Πυκνότητα: 0,534 g/cm
Σημείο τήξης: 453,65 K (180,50 ºC ή 356,90 ºF)
Σημείο βρασμού: 1615 K (1342 ºC ή 2448 ºF)
Κρίσιμο σημείο: 3220 K στα 67 MPa (παρεκβολή)
Κατάσταση στους 20ºC: Στερεά
Heat of Fusion: 3,00 kJ/mol
Θερμότητα εξάτμισης: 136 kJ/mol
Μοριακή θερμική χωρητικότητα: 24.860 J/mol·K
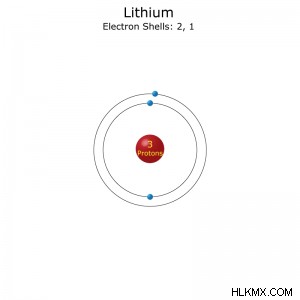
Ατομικά δεδομένα
Ατομική ακτίνα: 1,52 Å (εμπειρικό)
Ομοιοπολική ακτίνα: 1.30 Å
Ακτίνα Van der Waals: 1,82 Å
Συγγένεια ηλεκτρονίων: 59,633 kJ/mol
Ηλεκτραρνητικότητα: (Κλίμακα Pauling):0,98
1 Ενέργεια Ιονισμού: 520,222 kJ/mol
2 Ενέργεια Ιονισμού: 7298,15 kJ/mol
3 Ενέργεια Ιονισμού: 11815,044 kJ/mol
Συνήθεις καταστάσεις οξείδωσης: +1
Διασκεδαστικές πληροφορίες για το λίθιο

- Το λίθιο είναι το ελαφρύτερο μέταλλο.
- Το λίθιο έχει τη χαμηλότερη πυκνότητα από οποιοδήποτε μέταλλο. Το λίθιο μπορεί να επιπλέει στο νερό.
- Το λίθιο είναι ένα γυαλιστερό, μαλακό μέταλλο που αντιδρά βίαια με το νερό σχηματίζοντας μια ισχυρή διαβρωτική βάση. Το λίθιο αποθηκεύεται συχνά σε λάδι για αυτόν τον λόγο.
- Το λίθιο καίγεται με έντονο κόκκινο χρώμα. Το λίθιο προστίθεται στα πυροτεχνήματα για να κάνει κόκκινους σπινθήρες.
- Το λίθιο χρησιμοποιείται εκτενώς σε επαναφορτιζόμενες μπαταρίες. Χρησιμοποιείται επίσης σε πολλά κεραμικά.
- Το λίθιο χρησιμοποιείται ως πρόσθετο κράματος στο αλουμίνιο και το μαγνήσιο για μείωση του βάρους και βελτίωση της αντοχής.
- Το λίθιο δεν βρίσκεται στη στοιχειακή του μορφή. Το λίθιο παράγεται με ηλεκτρόλυση μεταλλευμάτων που περιέχουν λίθιο. Τα μεγαλύτερα κοιτάσματα μεταλλεύματος που περιέχει λίθιο βρίσκονται στη Χιλή.
- Η πρώτη ανθρωπογενής πυρηνική αντίδραση ήταν η μεταστοιχείωση του λιθίου σε τρίτιο.
- Το ανθρακικό λίθιο χρησιμοποιείται σε μικρές δόσεις για τη θεραπεία της μανιοκατάθλιψης και των διπολικών διαταραχών.
- Το δευτερίδιο του λιθίου είταν από την αρχή για το καύσιμο θερμοπυρηνικών βομβών. Το λίθιο παράγει τρίτιο το οποίο με τη σειρά του συντήκεται με το δευτέριο για να απελευθερώσει ενέργεια.
- Όπως και άλλα αλκαλικά μέταλλα, το λίθιο μπορεί να χρησιμοποιηθεί για τη δημιουργία σαπουνιού. Το σαπούνι λιθίου χρησιμοποιείται σε πολλά εμπορικά λιπαντικά.
Μάθετε περισσότερα σχετικά με τα στοιχεία στον περιοδικό πίνακα.




