Γεγονότα για το οξυγόνο
Το οξυγόνο είναι το όγδοο στοιχείο του περιοδικού πίνακα. Είναι ο ατομικός αριθμός 8 με το σύμβολο του στοιχείου Ο. Το οξυγόνο είναι περισσότερο γνωστό ως το στοιχείο που χρειαζόμαστε για να αναπνέουμε, αλλά έχει πολλές άλλες ενδιαφέρουσες ιδιότητες. Αυτά τα στοιχεία οξυγόνου περιέχουν χημικά και φυσικά δεδομένα μαζί με γενικές πληροφορίες και ιστορικό.

Βασικά στοιχεία για το οξυγόνο
Όνομα: Οξυγόνο
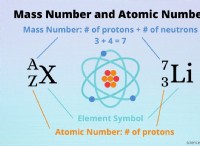
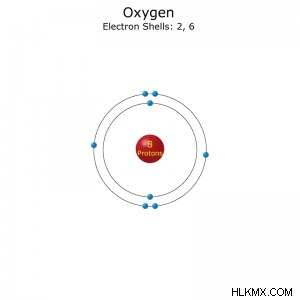
Ατομικός αριθμός: 8
Σύμβολο στοιχείου: O
Ομάδα: 16
Περίοδος: 2
Αποκλεισμός: p
Οικογένεια στοιχείων: μη μέταλλο
Ατομική μάζα: [15.999 03; 15.999 77] Κατευθυντήριες οδηγίες της IUPAC. Για μεμονωμένη τιμή, χρησιμοποιήστε 15.9994.
Διαμόρφωση ηλεκτρονίου: [He]2s2p(συντομογραφία) ή 1s2s2p(πλήρη)
Ανακάλυψη: Ο Carl Wilhelm Scheele το 1773 και ο Joseph Priestley το 1774. Ο Priestley έχει συχνά προτεραιότητα επειδή το έργο του δημοσιεύτηκε πρώτο. Και οι δύο άνδρες παρατήρησαν ότι η θέρμανση συγκεκριμένων οξειδίων απελευθέρωσε ένα αέριο που έκανε τα κεριά να καίγονται πιο φωτεινά. Ο Priestley προχώρησε λίγο πιο πέρα βάζοντας ένα ποντίκι σε ένα βάζο με οξυγόνο. Περίμενε ότι θα επιβιώσει μόνο λίγα λεπτά πριν πνιγεί. Αντίθετα, το ποντίκι ήταν ακόμα ζωντανό μετά από μια ώρα στο βάζο.
Προέλευση ονόματος: Ο Γάλλος χημικός Antoine Lavoisier ονόμασε το στοιχείο οξυγόνο από τις ελληνικές λέξεις oxys που σημαίνει «οξύ» και γονίδια που σημαίνει «σχηματισμός». Εκείνη την εποχή, πιστευόταν ότι όλα τα οξέα απαιτούσαν οξυγόνο για μέρος της αντίδρασης.
Ισότοπα:
Το φυσικό οξυγόνο αποτελείται από δύο σταθερά ισότοπα:Ο, Ο και Ο. Τα ραδιενεργά ισότοπα έχουν παραχθεί σε εργαστηριακές συνθήκες που κυμαίνονται από Ο έως Ο.
Ο
Το Oxygen-16 είναι ένα σταθερό ισότοπο που περιέχει 8 νετρόνια. Το 99,757% του φυσικού οξυγόνου είναι οξυγόνο-16.
Ο
Το Oxygen-17 είναι ένα σταθερό ισότοπο που περιέχει 9 νετρόνια. Το 0,038% του φυσικού οξυγόνου είναι οξυγόνο-17.
Ο
Το Oxygen-18 είναι ένα σταθερό ισότοπο που περιέχει 9 νετρόνια. Το 0,205% του φυσικού οξυγόνου είναι οξυγόνο-18.

Φυσικά δεδομένα
Πυκνότητα: 0,001308 g/cm
Σημείο τήξης: 54,36 K (−218,79 °C, −361,82 °F)
Σημείο βρασμού: 90,188 K (−182,962 °C, −297,332 °F)
Τριπλό σημείο: 54,361 K σε 0,1463 kPa
Κρίσιμο σημείο: 154.581 K στα 5.043 MPa
Κατάσταση στους 20ºC: Αέριο
Heat of Fusion: 0,444 kJ/mol για O2
Θερμότητα εξάτμισης: 6,82 kJ/mol για O2
Μοριακή θερμική χωρητικότητα: 29.378 J/mol·K για O2
Ατομικά δεδομένα
Ατομική ακτίνα: 1,52 Å
Ομοιοπολική ακτίνα: 0,64 Å
Ακτίνα Van der Waals: 1,55 Å
Συγγένεια ηλεκτρονίων: 140,976 kJ/mol
Ηλεκτραρνητικότητα: (Κλίμακα Pauling):3,44
1 Ενέργεια Ιονισμού: 1313,942 kJ/mol
2 Ενέργεια Ιονισμού: 3388.671 kJ/mol
3 Ενέργεια Ιονισμού: 5300,47 kJ/mol
4 Ενέργεια Ιονισμού: 7469,271 kJ/mol
5 Ενέργεια Ιονισμού: 10989,584 kJ/mol
6 Ενέργεια Ιονισμού: 13326.526 kJ/mol
7 Ενέργεια Ιονισμού: 71330,65 kJ/mol
8 Ενέργεια Ιονισμού: 84078,3 kJ/mol
Κατάσταση οξείδωσης: -2, -1 (κοινό), +2, +1 (ασυνήθιστο)

Διασκεδαστικά στοιχεία για το οξυγόνο
- Το οξυγόνο είναι ένα άχρωμο, άγευστο και άοσμο αέριο, αλλά το υγρό οξυγόνο έχει ένα ξεχωριστό μπλε χρώμα.
- Το οξυγόνο αποτελεί περίπου το 21% του αέρα που αναπνέετε κατ' όγκο.
- Σχεδόν ο μισός φλοιός της Γης είναι οξυγόνο κατά μάζα.
- Το οξυγόνο είναι το πιο άφθονο στοιχείο στο ανθρώπινο σώμα και αντιπροσωπεύει το 65% του βάρους σας.
- Όλα τα ζώα και τα φυτά χρειάζονται οξυγόνο για να ζήσουν.
- Το οξυγόνο δεν είναι εύφλεκτο. Ωστόσο, υποστηρίζει την καύση άλλων υλικών και δεν πρέπει να αποθηκεύεται κοντά σε εύφλεκτα υλικά.
- Το οξυγόνο διαλύεται εύκολα στο νερό. Αυτή η ιδιότητα καθιστά δυνατή τη ζωή κάτω από το νερό.
- Το αέριο οξυγόνο χρησιμοποιείται εκτενώς από τη βιομηχανία χάλυβα για την παραγωγή χάλυβα. Χρησιμοποιείται επίσης για την παραγωγή υπεροξειδίου του υδρογόνου και νιτρικού οξέος. Η ένωση εποξυαιθάνιο παράγεται για την κατασκευή των κοινών πολυμερών πολυεστέρα και PVC (πολυβινυλοχλωρίδιο)
- Τα πράσινα κύματα χρώματος στα σέλας προκαλούνται από τον ιονισμό του οξυγόνου στην ανώτερη ατμόσφαιρα.
- Το οξυγόνο σπάνια βρίσκεται μόνο του στη φύση. Το οξυγόνο συνδέεται με τον εαυτό του για να σχηματίσει διατομικό O2 . Το όζον είναι ένα άλλο μόριο καθαρού οξυγόνου με τύπο O3 .
- Το όζον είναι ζωτικής σημασίας για την απορρόφηση της επιβλαβούς υπεριώδους ακτινοβολίας από τον Ήλιο στην ανώτερη ατμόσφαιρα. Πιο κοντά στο έδαφος, ωστόσο, το όζον θεωρείται ρύπος και είναι επικίνδυνο για τη ζωή.
- Το οξυγόνο ήταν το πρότυπο για τη μέτρηση των ατομικών βαρών άλλων στοιχείων μέχρι το 1961. Αντικαταστάθηκε από τη μάζα του άνθρακα-12.
Μάθετε περισσότερα σχετικά με τα στοιχεία στον περιοδικό πίνακα.