Διαφορά μεταξύ ηλεκτρόφιλου και πυρηνόφιλου
Κύρια διαφορά – Ηλεκτρόφιλο εναντίον Πυρηνόφιλου
Οι χημικές αντιδράσεις μεταξύ οργανικών και ανόργανων χημικών ειδών συμβαίνουν κυρίως μέσω ηλεκτροφίλων και πυρηνόφιλων. Τα ηλεκτρόφιλα και τα πυρηνόφιλα μπορούν να οριστούν ως παράγωγα ατόμων ή μορίων. Η κύρια διαφορά μεταξύ ηλεκτροφίλου και πυρηνόφιλου είναι ότι τα ηλεκτρόφιλα είναι άτομα ή μόρια που μπορούν να δεχτούν ζεύγη ηλεκτρονίων, ενώ τα πυρηνόφιλα είναι άτομα ή μόρια που μπορούν να δωρίσουν ζεύγη ηλεκτρονίων.
Βασικές περιοχές που καλύπτονται
1. Τι είναι το Ηλεκτρόφιλο
– Ορισμός, Χαρακτηριστικά, Παραδείγματα
2. Τι είναι το πυρηνόφιλο
– Ορισμός, Χαρακτηριστικά, Παραδείγματα
3. Ποια είναι η διαφορά μεταξύ Ηλεκτρόφιλου και Πυρηνόφιλου
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Ηλεκτρόφιλο, Ηλεκτροφιλικότητα, Αντίδραση Ηλεκτρόφιλης Προσθήκης, Αντίδραση Ηλεκτρόφιλης Υποκατάστασης, Πυρηνόφιλο, Πυρηνόφιλο, Πυρηνόφιλο Αντίδραση Προσθήκης, Αντίδραση Πυρηνόφιλης Υποκατάστασης, Οξύ Lewis, Βάση Lewis 
Τι είναι ένα Ηλεκτρόφιλο
Ένα ηλεκτρόφιλο είναι ένα άτομο ή μόριο που μπορεί να δεχτεί ένα ζεύγος ηλεκτρονίων από ένα είδος πλούσιο σε ηλεκτρόνια και να σχηματίσει έναν ομοιοπολικό δεσμό. Τα ηλεκτρόφιλα είναι θετικά ή ουδέτερα φορτισμένα άτομα ή μόρια που έχουν ελεύθερα τροχιακά για τα εισερχόμενα ηλεκτρόνια.
Τα ηλεκτρόφιλα ονομάζονται οξέα Lewis λόγω της ικανότητάς τους να δέχονται ηλεκτρόνια. Ένα ηλεκτρόφιλο δημιουργείται όταν ένα άτομο ή ένα μόριο στερούνται ηλεκτρονίων για να υπακούσει στον κανόνα της οκτάδας ή να έχει ένα θετικό φορτίο που έπρεπε να εξουδετερωθεί για να γίνει σταθερό.
Για παράδειγμα, ιόν υδρονίου (H3 Ο) είναι ηλεκτρόφιλο. Έχει θετικό φορτίο και το άτομο υδρογόνου έχει ελεύθερο χώρο για τα εισερχόμενα ηλεκτρόνια. Επομένως, μπορεί να δεχτεί ζεύγη ηλεκτρονίων από μια βάση Lewis όπως –OH για να σχηματίσει H2 O μόριο.
Στην οργανική χημεία, τα ηλεκτρόφιλα υφίστανται αντίδραση προσθήκης και υποκατάστασης. Για παράδειγμα, η προσθήκη αλογόνων σε αλκένια λαμβάνει χώρα μέσω ηλεκτροφιλικών αντιδράσεων προσθήκης.
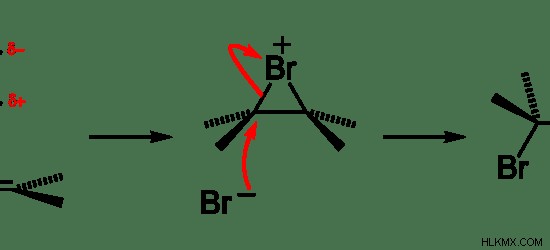
Εικόνα 01:Προσθήκη αλκενίου και βρωμίου
Οι αντιδράσεις ηλεκτρόφιλης υποκατάστασης περιλαμβάνουν την υποκατάσταση ενός ηλεκτρόφιλου, που αντικαθιστά μια λειτουργική ομάδα ενός μορίου. Συνηθέστερα, αντιδράσεις ηλεκτρόφιλης υποκατάστασης μπορούν να παρατηρηθούν με το βενζόλιο.
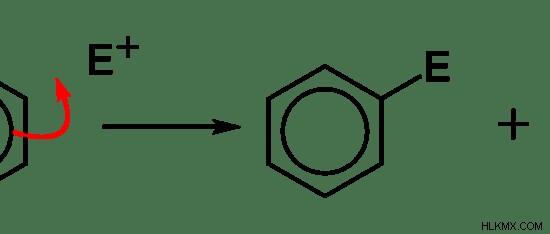
Εικόνα 02:Ηλεκτρόφιλη αντικατάσταση ενός ηλεκτρόφιλου σε βενζόλιο, που αντικαθιστά ένα άτομο υδρογόνου.
Η ισχύς ενός ηλεκτρόφιλου καθορίζεται από την ηλεκτροφιλικότητα του. Ηλεκτροφιλία είναι ένας όρος που χρησιμοποιείται για να υποδείξει την ηλεκτρόφιλη φύση ενός ηλεκτρόφιλου. Αυτή η ηλεκτροφιλικότητα εξαρτάται από παράγοντες όπως το φορτίο του ηλεκτρόφιλου.
Τι είναι το πυρηνόφιλο
Το πυρηνόφιλο είναι ένα άτομο ή μόριο που μπορεί να δώσει ζεύγη ηλεκτρονίων και λόγω της ικανότητάς τους ονομάζεται επίσης βάση Lewis . Τα πυρηνόφιλα μπορούν να δωρίσουν ηλεκτρόνια στα ηλεκτρόφιλα. Μόρια που έχουν δεσμούς pi ή άτομα ή μόρια με ζεύγη ελεύθερων ηλεκτρονίων δρουν ως πυρηνόφιλα.
Τα πυρηνόφιλα είναι συνήθως αρνητικά φορτισμένα. Ακόμη και τα ουδέτερα φορτισμένα μόρια με άτομα πλούσια σε ηλεκτρόνια μπορούν να συμπεριφέρονται ως πυρηνόφιλα. Τα πυρηνόφιλα εμφανίζουν επίσης συγκεκριμένες αντιδράσεις, όπως η πυρηνόφιλη προσθήκη και η αντίδραση πυρηνόφιλης υποκατάστασης.
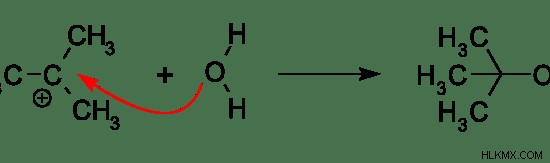
Εικόνα 03:Αντίδραση μεταξύ πυρηνόφιλου και ηλεκτροφίλου
Το παραπάνω παράδειγμα δείχνει την αντίδραση μεταξύ ενός πυρηνόφιλου και του ηλεκτροφίλου. Εδώ, H2 Το μόριο O δρα ως πυρηνόφιλο. Δωρίζει ηλεκτρόνια στο καρβοκατιόν που έχει θετικό φορτίο.
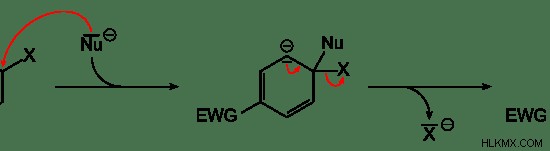
Εικόνα 04:Πυρηνόφιλη υποκατάσταση
Η παραπάνω εικόνα δείχνει μια πυρηνόφιλη αντίδραση υποκατάστασης. Το πυρηνόφιλο εμφανίζεται ως «Nu» και η λειτουργική ομάδα «Χ» στον δακτύλιο βενζολίου αντικαθίσταται από το πυρηνόφιλο. Στη συνέχεια, το πυρηνόφιλο συνδέεται στον δακτύλιο benne ενώ η ομάδα "X" εγκαταλείπει τον δακτύλιο βενζολίου. Επομένως, το "X" ονομάζεται η αποχωρούσα ομάδα.
Πυρηνοφιλικότητα είναι ένας σημαντικός όρος σχετικά με τα πυρηνόφιλα. Η πυρηνόφιλος καθορίζει την ισχύ ενός συγκεκριμένου πυρηνόφιλου. Αυτή η πυρηνόφιλη εξαρτάται από πολλούς παράγοντες όπως φορτίο, βασικότητα, πόλωση κ.λπ. Για παράδειγμα, όταν αυξάνεται το αρνητικό φορτίο του πυρηνόφιλου, αυξάνεται η πυρηνόφιλη. Αυτό σημαίνει ότι τα πυρηνόφιλα που φέρουν υψηλό αρνητικό φορτίο λειτουργούν ως εξαιρετικά πυρηνόφιλα.
Διαφορά μεταξύ ηλεκτρόφιλου και πυρηνόφιλου
Ορισμός
Ηλεκτρόφιλο: Ένα ηλεκτρόφιλο είναι ένα άτομο ή μόριο που μπορεί να δεχτεί ένα ζεύγος ηλεκτρονίων από ένα είδος πλούσιο σε ηλεκτρόνια και να σχηματίσει έναν ομοιοπολικό δεσμό.
Πυρηνόφιλο: Ένα πυρηνόφιλο είναι ένα άτομο ή μόριο που μπορεί να δώσει ζεύγη ηλεκτρονίων.
Ηλεκτρική φόρτιση
Ηλεκτρόφιλο: Τα ηλεκτρόφιλα είναι είτε θετικά είτε ουδέτερα φορτισμένα.
Πυρηνόφιλο: Τα πυρηνόφιλα είναι είτε αρνητικά φορτισμένα είτε ουδέτερα φορτισμένα.
Χημικές αντιδράσεις
Ηλεκτρόφιλο: Τα ηλεκτρόφιλα υφίστανται αντιδράσεις ηλεκτρόφιλης προσθήκης και ηλεκτρόφιλης υποκατάστασης.
Πυρηνόφιλο: Τα πυρηνόφιλα υφίστανται πυρηνόφιλες αντιδράσεις προσθήκης και πυρηνόφιλης υποκατάστασης.
Άλλα ονόματα
Ηλεκτρόφιλο: Τα ηλεκτρόφιλα ονομάζονται επίσης οξέα Lewis.
Πυρηνόφιλο: Τα πυρηνόφιλα ονομάζονται επίσης βάσεις Lewis.
Συμπέρασμα
Τα ηλεκτρόφιλα και τα πυρηνόφιλα παίζουν σημαντικό ρόλο στις χημικές αντιδράσεις σχετικά με την οργανική χημεία και την ανόργανη χημεία. Η κύρια διαφορά μεταξύ ηλεκτροφίλου και πυρηνόφιλου είναι ότι τα ηλεκτρόφιλα είναι άτομα ή μόρια που μπορούν να δεχτούν ζεύγη ηλεκτρονίων, ενώ τα πυρηνόφιλα είναι άτομα ή μόρια που μπορούν να δωρίσουν ζεύγη ηλεκτρονίων.




