Γεγονότα για το φθόριο
Το φθόριο είναι το ένατο στοιχείο του περιοδικού πίνακα. Αυτά τα στοιχεία φθορίου περιέχουν χημικά και φυσικά δεδομένα μαζί με γενικές πληροφορίες και ιστορικό.

Βασικά στοιχεία για το φθόριο
Όνομα: Φθόριο
Ατομικός αριθμός: 9
Σύμβολο στοιχείου: F
Ομάδα: 17
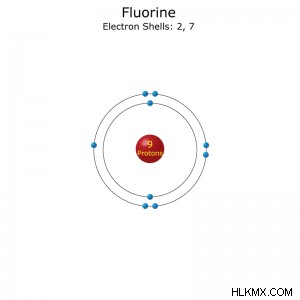
Περίοδος: 2
Αποκλεισμός: p
Οικογένεια στοιχείων: αλογόνο
Ατομική μάζα: 18.998 403 163(6)
Διαμόρφωση ηλεκτρονίου: [He]2s2p(συντομογραφία) ή 1s2s2p(πλήρη)
Ανακάλυψη: Ο Henri Moissan το 1886
Το φθόριο ήταν γνωστό ότι υπήρχε εδώ και πολλά χρόνια. Ήδη από τα μέσα του 1500, τα ορυκτά φθορίτη προστέθηκαν στη μεταλλουργία για να μειώσουν τα σημεία τήξης των μετάλλων. Το υδροφθορικό οξύ χρησιμοποιήθηκε από υαλουργούς του 18ου αιώνα για να χαράξουν γυαλί. Κανείς δεν μπόρεσε να απομονώσει αυτό το άπιαστο στοιχείο. Το 1886, ο Γάλλος χημικός Henri Moissan τελειοποίησε τελικά μια τεχνική για την απομόνωση καθαρού αερίου φθορίου. Ο Μοισάν θα κέρδιζε το Νόμπελ Χημείας του 1906 γι' αυτό το κατόρθωμα.
Προέλευση ονόματος: Το φθόριο ονομάζεται από ένα οξύ που παράγεται από ορυκτό φθορίτη γνωστό ως φθορικό οξύ. Ο Sir Humphry Davy πρότεινε το όνομα του άγνωστου στοιχείου στο όξινο φθόριο. φθορο- από το οξύ και -ine επειδή είχε ιδιότητες αλογόνου.
Ισότοπα:
Το φυσικό φθόριο έχει ένα σταθερό ισότοπο:F. Έχουν παραχθεί 18 γνωστά ραδιενεργά ισότοπα σε εργαστηριακές συνθήκες που κυμαίνονται από F έως F.
φά
Το φθόριο-19 είναι ένα σταθερό ισότοπο που περιέχει 10 νετρόνια και φυσική αφθονία 100%.

Φυσικά δεδομένα
Πυκνότητα: 0,001553 g/cm
Σημείο τήξης: 53,48 K(−219,67 °C, −363,41 °F)
Σημείο βρασμού: 85,03 K (−188,11 °C, −306,60 °F)
Τριπλό σημείο: 53,48 K στα 90 kPa
Κρίσιμο σημείο: 144,41 K στα 5,1724 MPa
Κατάσταση στους 20ºC: Αέριο
Θερμότητα εξάτμισης: 6,51 kJ/mol
Μοριακή θερμική χωρητικότητα: 23 J/mol·K για σταθερό όγκο (cv ) και 31 J/mol·K για σταθερή πίεση (cp )
Ατομικά δεδομένα
Ατομική ακτίνα: 1,47 Å
Ομοιοπολική ακτίνα: 0,64 Å
Ακτίνα Van der Waals: 1,35 Å
Συγγένεια ηλεκτρονίων: 1681,045 kJ/mol
Ηλεκτραρνητικότητα: (Κλίμακα Pauling):3,98
1 Ενέργεια Ιονισμού: 1313,942 kJ/mol
2 Ενέργεια Ιονισμού: 3374,17 kJ/mol
3 Ενέργεια Ιονισμού: 6050,441 kJ/mol
4 Ενέργεια Ιονισμού: 8407,713 kJ/mol
5 Ενέργεια Ιονισμού: 11022,755 kJ/mol
6 Ενέργεια Ιονισμού: 15164,128 kJ/mol
7 Ενέργεια Ιονισμού: 17867,734 kJ/mol
8 Ενέργεια Ιονισμού: 92038,447 kJ/mol
Κατάσταση οξείδωσης: -1
Διασκεδαστικά στοιχεία για το φθόριο
- Το φθόριο ήταν κάποτε γνωστό ως δολοφόνος χημικών. Το φθόριο είναι ένα εξαιρετικά αντιδραστικό στοιχείο και οι προσπάθειες απομόνωσής του αποδείχθηκαν επικίνδυνες για τους χημικούς που προσπάθησαν να το απομονώσουν. Οι χημικοί που τραυματίστηκαν ή σκοτώθηκαν από την αναζήτηση καθαρού φθορίου ήταν γνωστοί ως «Μάρτυρες του Φθορίου».
- Μερικά πρώτα σχολικά βιβλία και περιοδικά έχουν το σύμβολο του στοιχείου Fl για φθόριο.
- Το φθόριο έχει την υψηλότερη τιμή ηλεκτραρνητικότητας των στοιχείων και τη δεύτερη υψηλότερη συγγένεια ηλεκτρονίων.
- Φθόριο είναι το όνομα του ιόντος φθορίου.
- Το φθόριο είναι ένα ανοιχτό κίτρινο διατομικό αέριο σε θερμοκρασία δωματίου.
- Το φθόριο είναι εξαιρετικά τοξικό και διαβρωτικό.
- Το φθόριο είναι το 13ο πιο άφθονο στοιχείο στη Γη, αλλά το 24ο πιο άφθονο στοιχείο στο σύμπαν.
- Ο ορυκτός φθορίτης ή φθορίτης λάμπει στο σκοτάδι όταν εκτίθεται στο φως. Από εδώ προέρχεται ο όρος φθορισμός. Αποδεικνύεται ότι το φθόριο δεν έχει καμία σχέση με αυτήν την ιδιότητα. Μικρές ποσότητες ευρωπίου σε φθορίτη προκαλούν αυτό το φαινόμενο.
- Το φθοριούχο νάτριο είναι το πρόσθετο στην οδοντόκρεμα και στο πόσιμο νερό για την πρόληψη της τερηδόνας στα δόντια.
- Το φθόριο προσβάλλει μέταλλα. Το χαλύβδινο μαλλί θα αναφλεγεί όταν εκτεθεί σε καθαρό αέριο φθόριο.
- Η εμπορική παραγωγή φθορίου δεν υπήρχε έως ότου χρειάστηκε για τον εμπλουτισμό ουρανίου κατά τη διάρκεια του Β' Παγκοσμίου Πολέμου. Το εξαφθοριούχο ουράνιο χρησιμοποιείται για τον διαχωρισμό των διαφορετικών ισοτόπων ουρανίου.
Μάθετε περισσότερα σχετικά με τα στοιχεία στον περιοδικό πίνακα.




