Μέταλλα vs Αμέταλλα

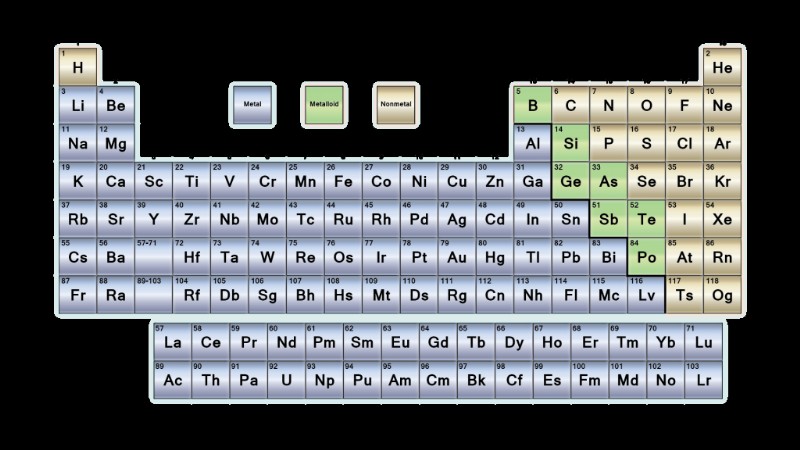
Τα στοιχεία μπορούν να ταξινομηθούν ως μέταλλα, αμέταλλα ή μεταλλοειδή. Στοιχεία με ορισμένα χαρακτηριστικά των μετάλλων και μερικά από τα αμέταλλα είναι μεταλλοειδή. Τα μέταλλα βρίσκονται στην αριστερή πλευρά του περιοδικού πίνακα. Τα μη μέταλλα βρίσκονται στη δεξιά πλευρά του τραπεζιού. Τα μεταλλοειδή εμφανίζονται σε ζιγκ-ζαγκ γραμμή στο τραπέζι, διαχωρίζοντας μέταλλα και αμέταλλα. Ακολουθεί μια ματιά στη διαφορά μεταξύ μετάλλων και μη μετάλλων.
| Μέταλλα | Μη μέταλλα |
| Μεταλλική λάμψη (γυαλιστερή) | Μη γυαλιστερό |
| Καλοί αγωγοί θερμότητας και ηλεκτρισμού | Κακοί αγωγοί θερμότητας και ηλεκτρισμού |
| Ελατό – μπορεί να κοπεί σε σεντόνια | Εύθραυστα στερεά |
| όλκιμο – μπορεί να τεντωθεί σε σύρμα | Μη αγώγιμο |
| Αδιαφανή λεπτά φύλλα | Διαφανή λεπτά φύλλα |
| Ηχητικός (ήχος κουδουνιού όταν χτυπιέται) | Μη ηχητικό |
| Συνήθως στερεό σε θερμοκρασία δωματίου | Στερεό, υγρό ή αέριο σε θερμοκρασία δωματίου |
| Σχηματίζουν κατιόντα (ιόντα θετικά φορτισμένα) | Σχηματίζουν ανιόντα (αρνητικά φορτισμένα ιόντα) |
| Συνήθως 1-3 ηλεκτρόνια στο εξωτερικό περίβλημα | Συνήθως 4-8 ηλεκτρόνια στο εξωτερικό περίβλημα |
| Σχηματίστε βασικά οξείδια | Σχηματίστε όξινα οξείδια |
| Καλοί αναγωγικοί παράγοντες | Καλοί οξειδωτικοί παράγοντες |
| Χαμηλή ηλεκτραρνητικότητα | Υψηλή ηλεκτραρνητικότητα |
| Χαμηλή ενέργεια ιονισμού | Υψηλή ενέργεια ιονισμού |
| Κυρίως υψηλά σημεία τήξης | Χαμηλά σημεία τήξης |
| Μεσαία έως μεγάλη ατομική ακτίνα | Μικρή έως ενδιάμεση ατομική ακτίνα |
Μέταλλα
Περίπου το 75% των στοιχείων στον περιοδικό πίνακα είναι μέταλλα. Επειδή τόσα πολλά στοιχεία είναι μέταλλα, υποδιαιρούνται σε μικρότερες ομάδες, συμπεριλαμβανομένων των αλκαλιμετάλλων, μετάλλων αλκαλικών γαιών, μετάλλων μετάπτωσης, μετά τη μετάβαση ή βασικών μετάλλων, λανθανιδών και ακτινιδίων. Τα περισσότερα μέταλλα αναγνωρίζονται εύκολα από τη γυαλιστερή, μεταλλική τους εμφάνιση. Όμως, μοιράζονται άλλες κοινές ιδιότητες μεταξύ τους. Μια κοινή ιδιότητα είναι ο μεταλλικός χαρακτήρας, που σημαίνει ότι τα άτομα μετάλλων χάνουν εύκολα ηλεκτρόνια.
Μεταλλικές φυσικές ιδιότητες
- Γυαλιστερό (γυαλιστερό)
- Καλοί αγωγοί θερμότητας και ηλεκτρισμού
- Υψηλό σημείο τήξης
- Υψηλή πυκνότητα (βαριά για το μέγεθός τους)
- Ελατό (μπορεί να σφυρηλατηθεί)
- όλκιμο (μπορεί να συρθεί σε καλώδια)
- Συνήθως στερεό σε θερμοκρασία δωματίου (εξαίρεση αποτελεί ο υδράργυρος)
- Αδιαφανές σαν λεπτό φύλλο (δεν φαίνεται μέσα από μέταλλα)
- Τα μέταλλα είναι ηχηρά ή παράγουν ήχο σαν καμπάνα όταν χτυπηθούν
Χημικές ιδιότητες Metal
- Έχουν 1-3 ηλεκτρόνια στο εξωτερικό περίβλημα κάθε ατόμου μετάλλου και χάνουν εύκολα ηλεκτρόνια
- Διαβρώνεται εύκολα (π.χ., καταστραφεί από οξείδωση, όπως αμαύρωση ή σκουριά)
- Χάνετε εύκολα ηλεκτρόνια
- Σχηματίστε οξείδια που είναι βασικά
- Έχουν χαμηλές τιμές ηλεκτραρνητικότητας
- Είναι καλοί αναγωγικοί παράγοντες
Μη μέταλλα
Τα αμέταλλα περιλαμβάνουν τις ομάδες αμέταλλων, αλογόνου και ευγενών αερίων στον περιοδικό πίνακα. Ενώ τα περισσότερα μέταλλα είναι στερεά σε θερμοκρασία δωματίου, υπάρχουν μη μεταλλικά στερεά, υγρά και αέρια. Τα αμέταλλα είναι μια ποικιλόμορφη συλλογή στοιχείων, αλλά έχουν κάποιες κοινές ιδιότητες.
Μη μεταλλικές φυσικές ιδιότητες
- Μη γυαλιστερή (θαμπή εμφάνιση, μερικές φορές άχρωμη)
- Κακοί αγωγοί θερμότητας και ηλεκτρισμού
- Μη αγώγιμα στερεά
- Εύθραυστα στερεά
- Μπορεί να είναι στερεά, υγρά ή αέρια σε θερμοκρασία δωματίου
- Διαφανές σαν λεπτό φύλλο
- Τα μη μέταλλα δεν είναι ηχητικά
Μη μεταλλικές χημικές ιδιότητες
- Συνήθως έχουν 4-8 ηλεκτρόνια στο εξωτερικό τους περίβλημα
- Αποκτήστε ή μοιραστείτε εύκολα ηλεκτρόνια σθένους
- Σχηματίστε οξείδια που είναι όξινα
- Έχουν υψηλότερες ηλεκτραρνητικότητες
- Είναι καλοί οξειδωτικοί παράγοντες
Μεταλλοειδή
Είναι χρήσιμο να γνωρίζουμε τη διαφορά μεταξύ μετάλλων και μη μετάλλων για να αναγνωρίσουμε μεταλλοειδή. Τα μεταλλοειδή έχουν κάποιες ιδιότητες των μετάλλων και κάποιες ιδιότητες των μη μετάλλων. Γενικά, τα μεταλλοειδή εμφανίζονται συχνά μεταλλικά, αλλά είναι πιο πιθανό να είναι ημιαγωγοί παρά αγωγοί. Όπως τα αμέταλλα, τα μεταλλοειδή δεν είναι ούτε ελατά ούτε όλκιμα. Ενώ είναι στερεά σε θερμοκρασία δωματίου, τα μεταλλοειδή έχουν χαμηλότερα σημεία τήξης από τα περισσότερα μέταλλα. Τα μεταλλοειδή έχουν τιμές ηλεκτραρνητικότητας ενδιάμεσες μεταξύ μετάλλων και μη μετάλλων.
Αναφορές
- Askeland, D.R.; Fulay, Ρ.Ρ.; Wright, J.W. (2011). Η Επιστήμη και η Μηχανική των Υλικών (6η έκδ.). Cengage Learning, Stamford, CT. ISBN 0-495-66802-8.
- Lide, D.R.; Frederikse, H.P.R. (επιμ.) (1998). Εγχειρίδιο CRC Χημείας και Φυσικής (79η έκδ.). CRC Press, Boca Raton, Φλόριντα. ISBN 0-849-30479-2.
- Tilley, R.J.D. (2004). Κατανοώντας τα Στερεά:Η Επιστήμη των Υλικών (4η έκδ.). John Wiley, Νέα Υόρκη.




