Εμπειρικός vs Μοριακός Τύπος
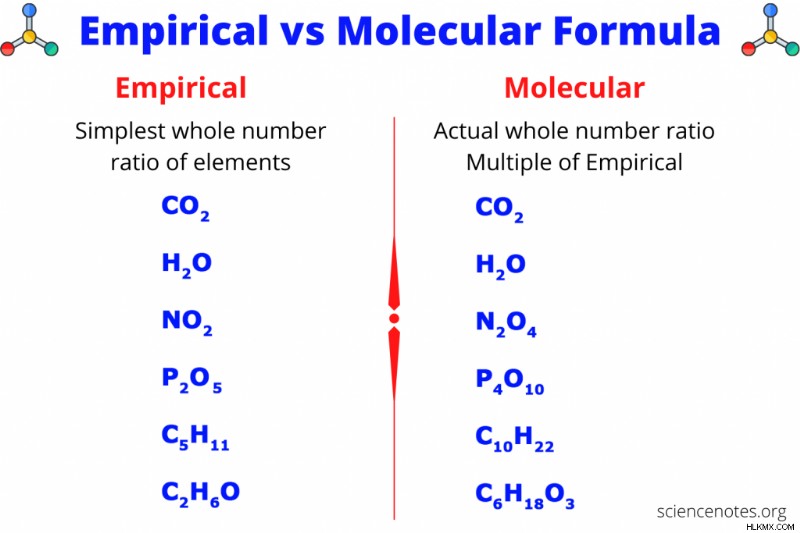
Ο εμπειρικός και ο μοριακός τύπος είναι δύο τύποι χημικών τύπων που σας λένε τις αναλογίες ή τις αναλογίες των στοιχείων σε μια ένωση. Ο εμπειρικός ή απλούστερος τύπος δίνει τη μικρότερη αναλογία ακέραιου αριθμού στοιχείων σε μια ένωση, ενώ ο μοριακός τύπος δίνει την πραγματική αναλογία ακέραιου αριθμού στοιχείων. Ο μοριακός τύπος είναι πολλαπλάσιο του εμπειρικού τύπου, αν και μερικές φορές πολλαπλασιάζεις τον εμπειρικό τύπο με "1", οπότε οι δύο τύποι είναι ίδιοι. Η ανάλυση καύσης και σύνθεσης δίνει πάντα τον εμπειρικό τύπο, αλλά μπορείτε να βρείτε τον μοριακό τύπο εάν γνωρίζετε το μοριακό βάρος. Ακολουθούν παραδείγματα εμπειρικών και μοριακών τύπων και επεξεργασμένων προβλημάτων που δείχνουν πώς να βρείτε αυτούς τους τύπους από ποσοστά μάζας και μοριακό βάρος.
Εμπειρικός τύπος
Ο εμπειρικός τύπος είναι ο απλούστερος τύπος για μια ένωση. Μπορείτε να πάρετε τον εμπειρικό τύπο από τον μοριακό τύπο διαιρώντας όλους τους δείκτες του τύπου με τον χαμηλότερο κοινό παρονομαστή. Για παράδειγμα, εάν ο μοριακός τύπος είναι H2 O2 , τότε ο χαμηλότερος κοινός παρονομαστής είναι 2. Διαιρώντας και τους δύο δείκτες με το 2 δίνεται ο απλούστερος τύπος του HO. Αν ο μοριακός τύπος είναι C6 H12 O6 , τότε ο χαμηλότερος κοινός παρονομαστής είναι 6 και ο απλούστερος τύπος είναι CH2 Ο. Αν ο μοριακός τύπος είναι CO2 , τότε ο χαμηλότερος κοινός παρονομαστής είναι 1 και ο εμπειρικός τύπος είναι ίδιος με τον μοριακό τύπο.
Μοριακός τύπος
Ο μοριακός τύπος είναι ο πραγματικός τύπος για μια ένωση. Όπως ο εμπειρικός τύπος, οι δείκτες είναι πάντα θετικοί ακέραιοι. Ο μοριακός τύπος είναι πολλαπλάσιο του εμπειρικού τύπου. Για παράδειγμα, ο εμπειρικός τύπος του εξανίου είναι C3 H7 , ενώ ο μοριακός τύπος του είναι C6 H14 . Και οι δύο δείκτες στον εμπειρικό τύπο πολλαπλασιάστηκαν επί 2 για να ληφθεί ο μοριακός τύπος.
Εμπειρικός εναντίον μοριακού τύπου
Ακολουθεί μια απλή σύγκριση του εμπειρικού έναντι του μοριακού τύπου:
| Εμπειρικός τύπος | Μοριακός τύπος |
| Η απλούστερη στοιχειακή σύνθεση ένωσης | Πραγματική στοιχειακή σύνθεση της ένωσης |
| Βρέθηκε από ποσοστά μάζας στοιχείων στην ένωση | Βρέθηκε χρησιμοποιώντας τον εμπειρικό τύπο και το μοριακό βάρος της ένωσης |
| Απλή αναλογία ακέραιου αριθμού στοιχείων | Πολλαπλάσιο του εμπειρικού τύπου που παραμένει ακέραιος λόγος |
| Βρέθηκε από ανάλυση καύσης ή σύνθεσης | Χρησιμοποιείται για τη σύνταξη χημικών αντιδράσεων και την κατάρτιση δομικών τύπων |
Βήματα για την εύρεση μοριακού τύπου από τον εμπειρικό τύπο
Μπορείτε να βρείτε τον μοριακό τύπο από τον εμπειρικό τύπο και το μοριακό βάρος.
Παράδειγμα
Για παράδειγμα, ας βρούμε τον μοριακό τύπο του εξανίου, γνωρίζοντας ότι ο εμπειρικός του τύπος είναι C3 H7 και το μοριακό του βάρος είναι 86,2 amu.
Αρχικά υπολογίστε το βάρος του τύπου του μορίου. Για να το κάνετε αυτό, αναζητήστε το ατομικό βάρος κάθε στοιχείου, πολλαπλασιάστε το καθένα με τον δείκτη του στον εμπειρικό τύπο και, στη συνέχεια, προσθέστε όλες τις τιμές για να λάβετε το βάρος του τύπου.
Άνθρακας:12,01 x 3 =36,03
Υδρογόνο:1,008 x 7 =7,056
Βάρος τύπου =36,03 + 7,056 =43,09 amu
Τώρα, ξέρετε ότι ο μοριακός τύπος πρέπει να είναι πολλαπλάσιο του εμπειρικού τύπου. Βρείτε την αναλογία μεταξύ μοριακού βάρους και βάρους τύπου διαιρώντας το μοριακό βάρος με το εμπειρικό βάρος:
μοριακό βάρος / εμπειρικό βάρος =86,2 / 43,09 =2
Συχνά, θα λάβετε μια δεκαδική τιμή, αλλά θα πρέπει να είναι κοντά σε έναν ακέραιο. Τέλος, πολλαπλασιάστε κάθε δείκτη στον εμπειρικό τύπο με αυτόν τον ακέραιο για να λάβετε τον μοριακό τύπο:
C3×2 H7×2 =C6 H14
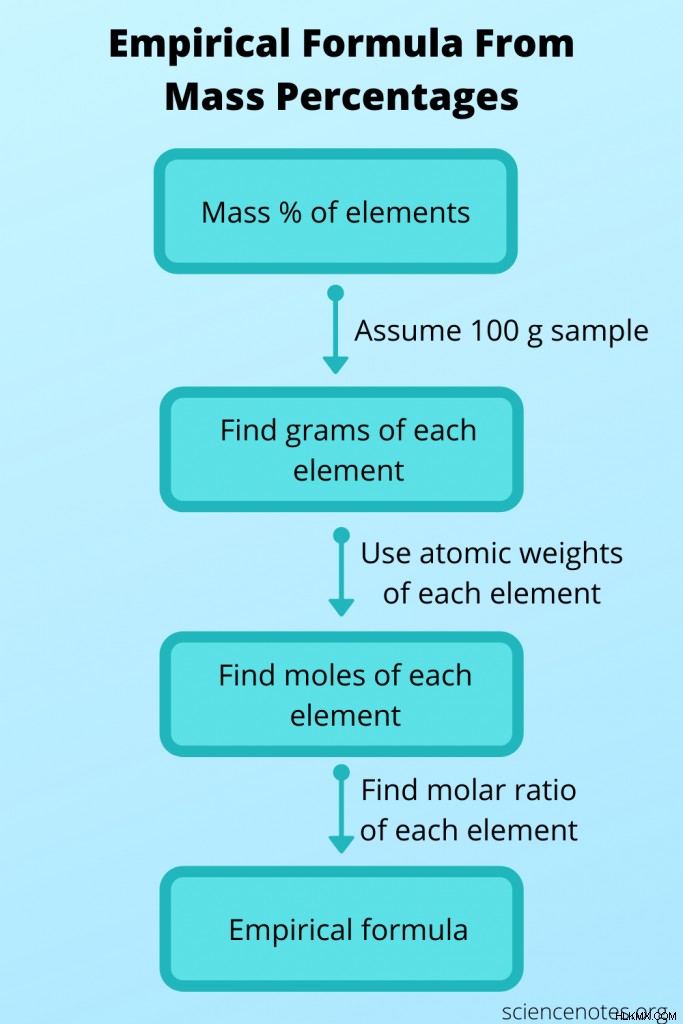
Μερικές φορές δεν γνωρίζετε τον εμπειρικό τύπο, αλλά μπορείτε να τον προσδιορίσετε από άλλα δεδομένα και στη συνέχεια να τον χρησιμοποιήσετε για να λάβετε τον μοριακό τύπο. Σε αυτή την περίπτωση, βρείτε τον μοριακό τύπο μιας ένωσης από το μοριακό της βάρος και τα ποσοστά μάζας κάθε ατόμου. Για να το κάνετε αυτό, ακολουθήστε τα εξής βήματα:
- Ας υποθέσουμε ότι έχετε ένα δείγμα 100 γραμμαρίων της ένωσης. Με αυτόν τον τρόπο, οι τιμές ποσοστού μάζας αθροίζονται σωστά για να σας δώσουν τον αριθμό των γραμμαρίων κάθε στοιχείου.
- Χρησιμοποιήστε τον περιοδικό πίνακα για να αναζητήσετε το ατομικό βάρος για κάθε στοιχείο. Θυμηθείτε, το ατομικό βάρος είναι οι αριθμοί των γραμμαρίων ανά ένα mole του στοιχείου. Τώρα μπορείτε να μετατρέψετε τον αριθμό των γραμμαρίων κάθε στοιχείου σε αριθμό moles.
- Βρείτε την αναλογία γραμμομορίων μεταξύ των στοιχείων διαιρώντας κάθε μοριακή τιμή με τον μικρότερο αριθμό γραμμομορίων. Χρησιμοποιήστε αυτήν την αναλογία για να λάβετε τον εμπειρικό τύπο.
- Υπολογίστε το βάρος του τύπου της ένωσης χρησιμοποιώντας τον εμπειρικό τύπο. Για να το κάνετε αυτό, πολλαπλασιάστε το ατομικό βάρος με τον δείκτη για κάθε στοιχείο και, στη συνέχεια, προσθέστε όλες τις τιμές.
- Βρείτε την αναλογία μεταξύ του μοριακού τύπου και του εμπειρικού τύπου διαιρώντας το μοριακό βάρος με το βάρος του τύπου. Στρογγυλοποιήστε αυτόν τον αριθμό ώστε να είναι ακέραιος.
- Πολλαπλασιάστε όλους τους δείκτες στον εμπειρικό τύπο με τον ακέραιο για να γράψετε τον μοριακό τύπο.
Παράδειγμα
Για παράδειγμα, βρείτε τον εμπειρικό τύπο και τον μοριακό τύπο του ασκορβικού οξέος (Βιταμίνη C) εάν η μοριακή μάζα είναι 176 amu και ένα δείγμα είναι 40,92% C, 4,58% H και 54,50% O κατά μάζα.
Αρχικά υποθέστε ότι έχετε ένα δείγμα 100 γραμμαρίων, το οποίο κάνει τη μάζα κάθε στοιχείου:
- 40,92 g C
- 4,58 g H
- 54,50 g O
Στη συνέχεια, αναζητήστε τα ατομικά βάρη αυτών των στοιχείων για να μάθετε πόσα μόρια έχετε από κάθε στοιχείο. Εάν δεν είστε βέβαιοι για αυτό το βήμα, ανατρέξτε στον τρόπο με τον οποίο μπορείτε να κάνετε μια μετατροπή γραμμαρίου σε mole.
- mol C =40,92 g x (1 mol/12,011 g) =3,407 mol C
- mol H =4,58 g x (1 mol/1,008 g) =4,544 mol H
- mol O =54,50 g x (1 mol/15,999 g) =3,406 mol O
Βρείτε την απλούστερη αναλογία ακέραιων αριθμών μεταξύ των στοιχείων διαιρώντας κάθε μοριακή τιμή με τη μικρότερη (3,406 σε αυτό το παράδειγμα). Προσέξτε για δεκαδικές τιμές όπως "1.5", "1.333" ή "1.667", επειδή υποδεικνύουν κλάσματα που μπορείτε να χρησιμοποιήσετε για να λάβετε ακέραιες τιμές.
- C =3,407 mol / 3,406 mol =1,0
- H =4,544 mol / 3,406 mol =1,334
- O =3,406 mol / 3,406 mol =1,0
Οι δείκτες στον εμπειρικό τύπο πρέπει να είναι ακέραιοι αριθμοί, αλλά το υδρογόνο είναι ένα κλάσμα. Πρέπει να αναρωτηθείτε με ποιον αριθμό θα χρειαστεί να πολλαπλασιάσετε για να πάρετε έναν ακέραιο αριθμό. Εφόσον το ".33" είναι η δεκαδική τιμή για το 1/3, μπορείτε να πολλαπλασιάσετε όλους τους αριθμούς επί 3 για να λάβετε ακέραιους αριθμούς.
- C =1,0 x 3 =3
- H =1,333 x 3 =4
- O =1,0 x 3 =3
Συνδέστε αυτές τις τιμές ως δείκτες, λαμβάνετε τον εμπειρικό τύπο:
C3 H4 O3
Για να βρείτε τον μοριακό τύπο, προσδιορίστε πρώτα τη μάζα του εμπειρικού τύπου πολλαπλασιάζοντας κάθε δείκτη με το ατομικό βάρος του ατόμου του και αθροίζοντας όλες τις τιμές:
(3 x 12,011) + (4 x 1,008) + (3 x 15,999) =88,062 amu
Εάν αυτή η τιμή είναι περίπου η ίδια με το μοριακό βάρος του δείγματος, τότε ο μοριακός τύπος είναι ίδιος με τον εμπειρικό τύπο. Επειδή το 88.062 είναι διαφορετικό από το 176, ξέρετε ότι ο μοριακός τύπος είναι πολλαπλάσιο του εμπειρικού τύπου. Βρείτε τον πολλαπλασιαστή διαιρώντας το μοριακό βάρος με το βάρος του εμπειρικού τύπου:
176 amu / 88,062 amu =2,0
Τέλος, πολλαπλασιάστε κάθε δείκτη στον εμπειρικό τύπο με αυτόν τον αριθμό για να πάρετε τον μοριακό τύπο:
μοριακός τύπος ασκορβικού οξέος =C3×2 H4×2 O3×2 =C6 H8 O6
Δομικοί τύποι
Ενώ οι εμπειρικοί και μοριακοί τύποι δηλώνουν τον τύπο και τον αριθμό των ατόμων σε μια ένωση, δεν σας λένε πώς είναι διατεταγμένα αυτά τα άτομα. Οι δομικοί τύποι υποδεικνύουν απλούς, διπλούς και τριπλούς δεσμούς, δακτυλίους και μερικές φορές τρισδιάστατη διαμόρφωση. Οι τύποι δομικών τύπων περιλαμβάνουν δομές Lewis, σκελετικές φόρμουλες, προβολές Newman, προβολές πριονιού, προβολές Haworth και προβολές Fischer.
Αναφορές
- Burrows, Andrew. (2013). Χημεία:Εισαγωγή της ανόργανης, οργανικής και φυσικής χημείας (2η έκδ.). Οξφόρδη. ISBN 978-0-19-969185-2.
- Petrucci, Ralph H.; Harwood, William S.; Herring, F. Geoffrey (2002). Γενική Χημεία:Αρχές και Σύγχρονες Εφαρμογές (8η έκδ.). Upper Saddle River, N.J:Prentice Hall. ISBN 978-0-13-014329-7.