Αμφοτερισμός – Αμφοτερικός Ορισμός και Παραδείγματα
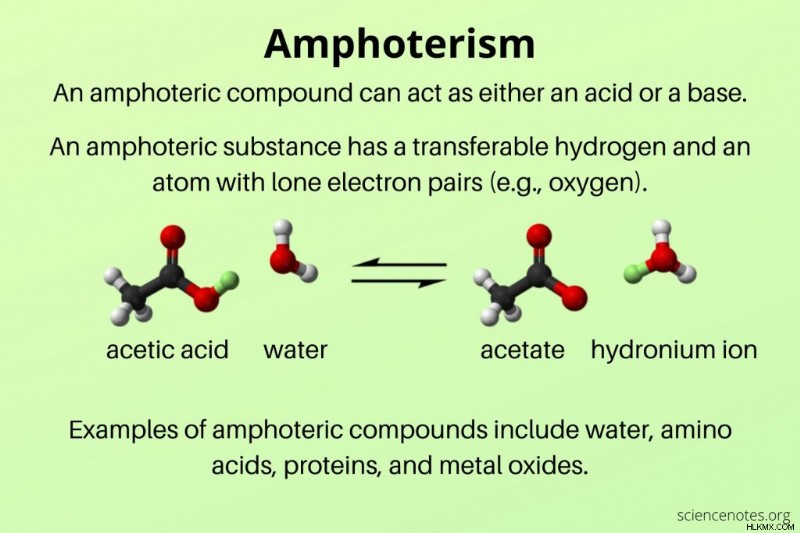
Στη χημεία, μιααμφοτερική Η ουσία είναι ένα χημικό είδος που μπορεί να λειτουργήσει και ως οξύ και ως βάση, ανάλογα με τις συνθήκες αντίδρασης. Το φαινόμενο ονομάζεταιαμφοτερισμός .
Ο αμφοτερισμός ισχύει για τα οξέα και τις βάσεις Bronsted-Lowry και Lewis. Η λέξη προέρχεται από την ελληνική λέξη αμφοτέρος ή αμφοτέροι , που σημαίνει «το καθένα ή και τα δύο» και σημαίνει ότι μια ουσία είναι «ή όξινη ή αλκαλική».
Αμφοτερικές Ουσίες
Μια αμφοτερική ουσία έχει ένα μεταβιβάσιμο υδρογόνο (πρωτόνιο) και ένα άτομο με μεμονωμένα ζεύγη ηλεκτρονίων. Παραδείγματα αμφοτερικών ουσιών περιλαμβάνουν νερό, αμινοξέα, πρωτεΐνες και πολλά οξείδια και υδροξείδια μετάλλων.
Τα οξείδια και τα υδροξείδια του αργιλίου, του αντιμονίου, του αρσενικού, του αντιμονίου, του βισμούθιου, του βηρυλλίου, του χρωμίου, του κοβαλτίου, του χαλκού, του γαλλίου, του γερμανίου, του χρυσού, του σιδήρου, του μολύβδου, του αργύρου, του τελλουρίου, του κασσίτερου και του ψευδαργύρου είναι αμφοτερικά. Ωστόσο, τα οξείδια των αλκαλικών μετάλλων και των αλκαλικών γαιών σχηματίζουν μόνο βασικά οξείδια και δεν είναι αμφοτερικά. Τα πιο αμφοτερικά οξείδια και υδροξείδια μετάλλων προέρχονται από μέταλλα που βρίσκονται κοντά στο κέντρο του περιοδικού πίνακα.
Ορισμένες ουσίες που συνήθως θεωρούνται είτε οξύ είτε βάση είναι στην πραγματικότητα αμφοτερικές. Για παράδειγμα, θειικό οξύ (H2 SO4 ) δρα ως οξύ στο νερό, αλλά δρα ως βάση ή είναι αμφοτερικό στα υπεροξέα. Γενικά, τα οξέα που μπορούν να δώσουν πολλαπλά ιόντα υδρογόνου είναι αμφοτερικά. Ομοίως, οι βάσεις με πολύ φορτισμένα μεταλλικά κατιόντα είναι αμφοτερικές.
Παραδείγματα Αμφοτερισμού
Για παράδειγμα, σκεφτείτε τον αμφοτερισμό του νερού (H2 O):
Το νερό δέχεται ένα πρωτόνιο όταν αντιδρά με ένα οξύ, όπως το υδροχλωρικό οξύ (HCl).
H2 O + HCl ⇌ H3 O + Cl
Το νερό δίνει ένα πρωτόνιο όταν αντιδρά με μια βάση, όπως η αμμωνία (NH3 ).
H2 O + NH3 ⇌ NH4 + OH
Ομοίως, αμφοτερικά οξείδια μετάλλων, όπως το οξείδιο του αλουμινίου (Al2 O3 ) δρα ως βάση όταν αντιδρά με οξύ και ως οξύ όταν αντιδρά με βάση.
Al2 O3 (s) + 6H3 0(aq) + 3H2 O(l) → 2[Al(OH2 )6 ](aq)
Al2 O3 (s) + 2OH(aq) + 3H2 O(l) → 2[Al(OH)4 ](aq)
Πώς να αναγνωρίζετε Αμφοτερικές Ουσίες
Για να προσδιορίσετε μια αμφοτερική ουσία, αναζητήστε την ικανότητα προσθήκης και αφαίρεσης ιόντων υδρογόνου από άλλα μόρια. Η αμφοτερική ουσία μπορεί να περιέχει πολλαπλά ιόντα υδρογόνου, τόσο όξινα όσο και βασικά συστατικά στο ίδιο μόριο ή πολλαπλά φορτία στο κατιόν ή το ανιόν του.
Μπορεί να σας βοηθήσει να δείτε ένα είδος που δεν είναι αμφοτερικός. Για παράδειγμα, το νιτρώδες οξύ (HNO2 ) είναι οξύ, δεν είναι αμφοτερικό γιατί δεν μπορεί να χρησιμεύσει ως βάση. Διασπάται για να απελευθερώσει ένα κατιόν υδρογόνου και το ΝΟ2 ανιόν. Το νιτρώδες οξύ δίνει μόνο ένα ιόν υδρογόνου ή πρωτόνιο. Δεν μπορεί να δεχτεί άλλα πρωτόνια, ενώ το ΟΧΙ2 Το ανιόν (η συζευγμένη βάση) δεν μπορεί να δωρίσει κανένα.
HNO2 → H + ΟΧΙ2 −
Σχετικοί Όροι
Αμφίπρωτο :Αμφιπρωτικό είδος είναι ένας τύπος αμφοτερικών ουσιών που είτε δέχεται είτε δωρίζει ένα πρωτόνιο (Η), ανάλογα με τις συνθήκες. Σύμφωνα με τη θεωρία των οξέων και βάσεων Lewis, τα αμφιπρωτικά είδη είναι αμφοτερικά, αλλά δεν είναι όλες οι αμφοτερικές ουσίες αμφιπρωτικές. Σύμφωνα με τη θεωρία των οξέων και βάσεων Bronsted-Lowry, το αμφοτερικό και το αμφιπρωτικό σημαίνουν το ίδιο πράγμα.
Αμφολύτες :Οι αμφολύτες είναι αμφοτερικές ενώσεις που περιέχουν τόσο όξινη όσο και βασική ομάδα. Για παράδειγμα, ένα αμινοξύ έχει μια αμινομάδα ικανή να δώσει υδρογόνο και μια καρβοξυλική ομάδα ικανή να δεχτεί υδρογόνο.
Αναφορές
- Housecroft, C. E.; Sharpe, A. G. (2004). Ανόργανη Χημεία (2η έκδ.). Prentice Hall. ISBN 978-0-13-039913-7.
- IUPAC (1997). "Αμφοτερικός". Compendium of Chemical Terminology (2η έκδ.) (the “Gold Book”). Επιστημονικές Εκδόσεις Blackwell. ISBN 0-9678550-9-8. doi:10.1351/goldbook.A00306
- Petrucci, Ralph H.; Harwood, William S.; Herring, F. Geoffrey (2002). Γενική Χημεία:Αρχές και Σύγχρονες Εφαρμογές (8η έκδ.). Upper Saddle River, N.J:Prentice Hall. ISBN 978-0-13-014329-7.
- Skoog, Douglas A.; West, Donald M.; Holler, F. James; Crouch, Stanley R. (2014). Βασικές αρχές της αναλυτικής χημείας (9η έκδ.). Belmont, CA. ISBN 978-0-495-55828-6.




