Υποχλωριώδες ασβέστιο – Δομή, ιδιότητες και χρήσεις του
Πρέπει να γνωρίζετε τη χημική «σκόνη λεύκανσης» και τη βασική χρήση της. Η λευκαντική σκόνη είναι μια γενική ονομασία και η ακριβής περιεκτικότητα οποιασδήποτε σκόνης λεύκανσης εξαρτάται από τις βιομηχανικές διαδικασίες που χρησιμοποιούνται για την παραγωγή της.
Ξέρετε όμως ποια είναι τα χημικά συστατικά της σκόνης λεύκανσης; Τι είναι το υποχλωριώδες ασβέστιο; Ποια είναι η δομή του υποχλωριώδους ασβεστίου; Ποια είναι τα πλεονεκτήματα και τα μειονεκτήματά του;
Για να λάβετε απάντηση σε όλες αυτές τις ερωτήσεις, ακολουθήστε αυτό το άρθρο.
Τι είναι το υποχλωριώδες ασβέστιο;
Μια χημική ένωση, το υποχλωριώδες ασβέστιο, έχει χημικό τύπο Ca(ClO)2. Είναι κοινώς γνωστό ως λευκαντική σκόνη, άλας ασβεστίου υποχλωριώδους οξέος, χλωριούχος ασβέστης και χλωριωμένος ασβέστης. Είναι μια ηλεκτροστατική ή ιοντική ένωση που περιέχει ένα Ca2+ (ιόν ασβεστίου) και δύο ClO- (υποχλωριώδη ιόντα).
Για να απαντήσω, τι είναι το υποχλωριώδες ασβέστιο; Είναι μια λευκή, συμπυκνωμένη χημική ουσία που διατίθεται στην αγορά σε μορφή σκόνης, κρυστάλλου ή δισκίου. Η βασική χρήση του υποχλωριώδους ασβεστίου είναι η απολύμανση και η απολύμανση του νερού της πισίνας και του πόσιμου νερού. Σε σύγκριση με άλλες πηγές χλωρίου για επεξεργασία νερού, είναι ευκολότερο και ασφαλέστερο στη χρήση.
Αν και είναι σταθερό σε θερμοκρασία δωματίου, αποσυντίθεται αργά σε υγρές συνθήκες, δίνοντάς του μια χαρακτηριστική μυρωδιά «χλωρίου». Είναι ενεργό συστατικό σε σκόνη λεύκανσης, χλωριωμένο ασβέστη κ.λπ.
Ιστορικό του υποχλωριώδους ασβεστίου
Στα τέλη του 18ου αιώνα, ο Charles Tennant και ο Charles Macintosh ανέπτυξαν μια βιομηχανική διαδικασία για την παραγωγή χλωριούχου ασβέστη, δηλαδή υποχλωριώδους ασβεστίου. Το 1799 κατοχυρώθηκε με δίπλωμα ευρεσιτεχνίας. Κατά τη διάρκεια του Πρώτου Παγκοσμίου Πολέμου, οι γιατροί το χρησιμοποιούσαν σε μεγάλο βαθμό για την απολύμανση πληγών και χαρακωμάτων.
Δομή υποχλωριώδους ασβεστίου
Είναι ένα ανόργανο σύμπλοκο που έχει τον χημικό τύπο Ca(ClO)2. Είναι λευκό, ελαφρώς διαλυτό στερεό. Είναι μια από τις κύριες ενώσεις των υποχλωριωδών αλάτων.
Η δομή του υποχλωριώδους ασβεστίου αποτελείται από ένα υποχλωριώδες ανιόν και ένα κατιόν ασβεστίου. Το κατιόν ασβεστίου (Ca2+) συντονίζεται σε έξι άτομα Ο σε μια παραμορφωμένη οκταεδρική γεωμετρία. Το υποχλωριώδες ανιόν (ClO-) είναι ευθύ ή γραμμικό στη δομή και συνδέεται με το κατιόν του ασβεστίου μέσω ατόμων οξυγόνου.
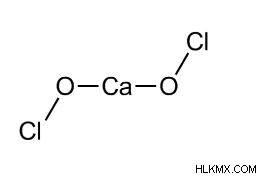
Η δομή του υποχλωριώδους ασβεστίου δίνεται παρακάτω:
Παρασκευή υποχλωριώδους ασβεστίου
Υπάρχουν δύο τρόποι παρασκευής υποχλωριώδους ασβεστίου. Αυτά είναι
1. Διαδικασία ασβεστίου:
Βιομηχανικά, το υποχλωριώδες ασβέστιο παρασκευάζεται με επεξεργασία ασβεστόνερου με αέριο χλώριο. Καθώς το ασβεστόνερο περιέχει ασβέστιο, αυτή η διαδικασία είναι γενικά γνωστή ως διαδικασία ασβεστίου. Η χημική αντίδραση λαμβάνει χώρα ως εξής
2Ca(OH)2 + 2Cl2 → Ca(OCl)2 + CaCl2 + 2H2O
Η αντίδραση διαχειρίζεται σε στάδια για να δώσει διαφορετικές συνθέσεις, η καθεμία με διάφορες συγκεντρώσεις χλωριούχου ασβεστίου, υποχλωριώδες και μη μετατρεπόμενο ασβέστη.
2. Διαδικασία νατρίου:
Σε αυτή τη διαδικασία, ο σβησμένος ασβέστης υποβάλλεται σε επεξεργασία με αέριο χλώριο και υδροξείδιο του νατρίου για να δώσει ένα μίγμα υποχλωριώδους ασβεστίου Ca(ClO)2, χλωριούχου ασβεστίου CaCl2, νερού και χλωριούχου νατρίου NaCl. Η αντίδραση λαμβάνει χώρα ως εξής
2Ca(OH)2 + 3Cl2 + 2NaOH → Ca(OCl)2 + CaCl2 + 2H2O + 2NaCl
Ιδιότητες υποχλωριώδους ασβεστίου
Οι ιδιότητες του υποχλωριώδους ασβεστίου ταξινομούνται σε δύο κατηγορίες. Αυτά δίνονται παρακάτω:
1. Φυσικές ιδιότητες:
Μεταξύ των ιδιοτήτων του υποχλωριώδους ασβεστίου, οι φυσικές ιδιότητες καθορίζουν την εμφάνισή του, τον χημικό τύπο, τη φύση, τη μάζα και άλλα χαρακτηριστικά. Μερικά από αυτά δίνονται παρακάτω:
- Ο μοριακός τύπος του υποχλωριώδους ασβεστίου είναι Ca(OCl)2.
- Υπάρχει σε λευκή-γκρι κοκκώδη μορφή υλικού.
- Η μοριακή μάζα του υποχλωριώδους ασβεστίου είναι 142,98 g/mol.
- Στους 20°C, η πυκνότητά του είναι 2,35 g/cm³.
- Το σημείο τήξης του υποχλωριώδους ασβεστίου είναι 100°C και το σημείο βρασμού του είναι 175°C.
- Είναι πολύ διαλυτό στο αλκοόλ.
- Σε θερμοκρασία δωματίου, η διαλυτότητα του υποχλωριώδους ασβεστίου στο νερό είναι 21 g/100 mL.
- Είναι άφλεκτη ουσία αλλά θα επιταχύνει τον ρυθμό καύσης εύφλεκτων υλικών.
- Έχει οσμή χλωρίου.
- Το υποχλωριώδες ασβέστιο είναι γενικά διαθέσιμο ως σφαιρίδια, λευκή σκόνη ή επίπεδες πλάκες.
- Το ειδικό βάρος του υποχλωριώδους ασβεστίου στο νερό είναι 1,21 g/cm³.
2. Χημικές ιδιότητες:
Μεταξύ των ιδιοτήτων του υποχλωριώδους ασβεστίου, οι χημικές ιδιότητες καθορίζουν τη φύση της ένωσης προς διαφορετικά αντιδραστήρια. Μερικά από αυτά δίνονται παρακάτω:
- Αποσυντίθεται εύκολα στο νερό.
- Κατά τη θέρμανση, το υποχλωριώδες ασβέστιο απελευθερώνει χλώριο και οξυγόνο.
- Το υποχλωριώδες ασβέστιο δεν είναι εύφλεκτο αλλά δρα ως οξειδωτικό με εύφλεκτο υλικό.
- Μπορεί να αντιδράσει εκρηκτικά με αμίνες, αμμωνία ή οργανικά σουλφίδια.
- Καθώς δέχεται εύκολα ιόντα Η⁺, το υποχλωριώδες ασβέστιο είναι μια ισχυρή βάση.
- Η διάλυση του υποχλωριώδους ασβεστίου στο νερό αποσυντίθεται σε υποχλωριώδες ιόντα και ιόντα ασβεστίου. Επιπλέον, τα υποχλωριώδη ιόντα δέχονται ιόντα Η+ από μόρια νερού και ελευθερώνουν ιόντα ΟΗ-.
ClO- + H2O → HClO + OH-
- Μπορεί να δεχτεί εύκολα ηλεκτρόνια. Ως εκ τούτου, δρα ως ισχυρός οξειδωτικός παράγοντας.
- Αντιδρά με το υδροχλωρικό οξύ και δίνει χλωριούχο ασβέστιο, χλώριο και νερό. Η αντίδραση ακολουθεί ως
4HCl + Ca(ClO)2 → CaCl2 + Cl2 + H2O
- Αντιδρά με το διοξείδιο του άνθρακα (CO2) σχηματίζοντας ανθρακικό ασβέστιο (CaCO3) και απελευθερώνει χλώριο.
2Ca(ClO)2 + 2CO2 → 2CaCO3 + 2Cl2 + O2
Χρήσεις υποχλωριώδους ασβεστίου
Οι χρήσεις του υποχλωριώδους ασβεστίου είναι να καθιστά το πόσιμο νερό ασφαλές και να απολυμαίνει μεγάλες ποσότητες νερού. Στις πισίνες, βοηθά στην απολύμανση των υδάτινων σωμάτων και σκοτώνει τα μικρόβια. Μερικές άλλες χρήσεις του υποχλωριώδους ασβεστίου είναι
- Στην οργανική χημεία, είναι ιδιαίτερα χρήσιμο λόγω της συμπεριφοράς του οξειδωτικού παράγοντα.
- Οι χρήσεις του υποχλωριώδους ασβεστίου είναι για λεύκανση κάνναβης, βαμβακιού, ινών, απολύμανση επιφανειών, πολτού και αμύλου και ως απολυμαντικό για την επεξεργασία του νερού.
- Χρησιμοποιείται και σε ορισμένα διαλύματα λεύκανσης.
- Χρησιμοποιείται επίσης ως στερεός πυροσβεστήρας.
- Λόγω της παρουσίας αντιδραστικού χλωρίου, το υποχλωριώδες ασβέστιο χρησιμοποιείται για την επεξεργασία λυμάτων και πόσιμου νερού.
- Διασπά τους δεσμούς κετοξέος και γλυκόλης λαμβάνοντας αποσαθρωμένα καρβοξυλικά οξέα ή αλδεΰδες.
- Χρησιμοποιείται στην παρασκευή χλωροφορμίου κατά τις αντιδράσεις αλοφορμίου.
- Το υποχλωριώδες ασβέστιο χρησιμοποιείται επίσης σε σκληρά νερά για να αποφευχθεί η απόφραξη των φίλτρων ή των σωλήνων.
- Χρησιμοποιείται στην απολύμανση και την απόσμηση σε βιομηχανίες ποτών, επεξεργασίας τροφίμων και ζάχαρης.
- Βοηθά στο φινίρισμα και την επιπλέον γυαλάδα στη βιομηχανία χαλιών.
- Το υποχλωριώδες ασβέστιο (γνωστό ως σκόνη λεύκανσης) χρησιμοποιείται επίσης για λινό και λεύκανση βαμβακιού.
- Λειτουργεί ως ελεγκτής κουνουπιών εξαφανίζοντας τις προνύμφες κουνουπιών σε αποχετεύσεις, υδρορροές, λίμνες κ.λπ.
Είναι επικίνδυνο το υποχλωριώδες ασβέστιο;
Αν και υπάρχουν πολλές χρήσεις για το υποχλωριώδες ασβέστιο, μπορεί να προκύψει ένα ερώτημα:είναι το υποχλωριώδες ασβέστιο επικίνδυνο; Εάν το χρησιμοποιείτε με προσοχή και προφύλαξη, δεν είναι τόσο επικίνδυνο. Αλλά η χρήση του χωρίς προφυλάξεις μπορεί να προκαλέσει βίαια αποτελέσματα. Μερικές από τις παρενέργειες της χρήσης υποχλωριώδους ασβεστίου είναι
- Σε επαφή με το νερό ή την υγρασία, απελευθερώνει αέριο χλώριο. Μπορεί να οδηγήσει σε ορισμένα προβλήματα υγείας.
- Υπό την παρουσία ενός οξέος, παράγει εξαιρετικά τοξικούς ατμούς αερίου χλωρίου.
- Η μέτρια χρήση διαλύματος υποχλωριώδους ασβεστίου μπορεί να προκαλέσει ερεθισμό του δέρματος. Μερικές φορές μπορεί να προκαλέσει σοβαρά δερματικά εγκαύματα.
- Δείχνει διαβρωτικά αποτελέσματα σε υγρούς ιστούς όπως μάτια, ανώτερες αναπνευστικές οδούς κ.λπ.
- Η εισπνοή υποχλωριώδους ασβεστίου μπορεί να προκαλέσει βήχα, αναπνευστικά προβλήματα και δύσπνοια.
- Πιο συμπυκνωμένα διαλύματα υποχλωριώδους ασβεστίου μπορεί να προκαλέσουν σημαντικά εγκαύματα οισοφάγου και στομάχου.
Σύνοψη
Συνοψίζοντας, αυτό που είναι το υποχλωριώδες ασβέστιο είναι ένα σημαντικό άλας υποχλωριώδους οξέος και παρασκευάζεται με επεξεργασία του πολτού ασβέστη, Ca(OH)2 με Cl2. Είναι μια σταθερή ένωση και έχει την εμπορική ονομασία «perchloron». Μερικές φορές, χρησιμοποιείται αντί της σκόνης λεύκανσης.
Λόγω των μη υγροσκοπικών ιδιοτήτων του, είναι ανώτερη από τη λευκαντική σκόνη. Το υποχλωριώδες ασβέστιο διατίθεται στο εμπόριο, αλλά τις περισσότερες φορές παράγεται επί τόπου στο σημείο χρήσης. Είναι μια ευρέως χρησιμοποιούμενη ανόργανη ένωση.
Το υποχλωριώδες ασβέστιο αποσυντίθεται σε επαφή με το νερό και απελευθερώνει χλώριο. Παραμένει σταθερό γιατί το υποχλωριώδες ασβέστιο αποσυντίθεται μόνο σε επαφή με το νερό. Γενικά, η σκόνη λεύκανσης είναι ένα μείγμα πολλών ενώσεων χλωρίου που απελευθερώνουν εκκολαπτόμενο οξυγόνο.
Συχνές ερωτήσεις
1. Ποια είναι τα πλεονεκτήματα και τα μειονεκτήματα της χρήσης υποχλωριώδους ασβεστίου;
Α) Τα βασικά πλεονεκτήματα και μειονεκτήματα της χρήσης υποχλωριώδους ασβεστίου είναι
Πλεονεκτήματα:
- Είναι εύκολο για σκοπούς μεταφοράς και αποθήκευσης.
- Μπορείτε να το αποθηκεύσετε για μεγάλο χρονικό διάστημα.
- Η απλή και αποτελεσματική χρήση του το καθιστά προτιμότερο από άλλες ενώσεις επεξεργασίας νερού με χλώριο.
- Είναι μια οικονομικά αποδοτική χημική ουσία και εύκολα διαθέσιμη.
Μειονεκτήματα:
- Μπορεί να προκαλέσει απόφραξη.
- Χρειάζεται κατάλληλη αποθήκευση. Διαρροή ακόμη και μικρής ποσότητας μπορεί να προκαλέσει βίαια αποτελέσματα.
- Έχει χαμηλή διαλυτότητα.
- Η έκθεση στη φωτιά μπορεί να οδηγήσει σε απότομη αύξηση της έντασης της φωτιάς.
- Η τελική συγκέντρωση χλωρίου στο νερό εξαρτάται από τον βαθμό διάλυσης που επιτυγχάνεται.
2) Γιατί πρέπει να αποθηκεύουμε το υποχλωριώδες ασβέστιο σε ξηρό μέρος;
Α) Το υποχλωριώδες ασβέστιο πρέπει να φυλάσσεται σε ξηρό, καλά αεριζόμενο χώρο κάτω από 50ºC, απομονωμένο από οξέα, αμίνες, αμμωνία και άλλους χλωριωτικούς ή οξειδωτικούς παράγοντες. Καθώς αυτές οι ενώσεις είναι πολύ εύφλεκτες όταν εκτίθενται και το υποχλωριώδες ασβέστιο δρα ως οξειδωτικός παράγοντας, αποθηκεύεται σε ξηρό μέρος.
3) Ποια είναι η λειτουργία του υποχλωριώδους ασβεστίου;
Α) Το υποχλωριώδες ασβέστιο είναι λευκαντικός παράγοντας. Μπορεί να παράγει χλώριο που δρα ως οξειδωτικός παράγοντας. Γι' αυτό το υποχλωριώδες ασβέστιο ή η σκόνη λεύκανσης χρησιμοποιείται ως καθαριστικό και απολυμαντικό.
4) Ποια είναι η διαφορά μεταξύ του υποχλωριώδους ασβεστίου και της σκόνης λεύκανσης;
Α) Το υποχλωριώδες ασβέστιο είναι μια ανόργανη ένωση με τον τύπο Ca(OCl)2. Αυτή η ένωση είναι σχετικά σταθερή και έχει μεγαλύτερο διαθέσιμο χλώριο από το διάλυμα λεύκανσης. Δεν είναι πολύ διαλυτό στο νερό και χρησιμοποιείται κατά προτίμηση σε μαλακό έως μέτρια σκληρό νερό.
Η λευκαντική σκόνη συνδυάζει χλωριούχο ασβέστιο, υποχλωριώδες ασβέστιο και υδροξείδιο του ασβεστίου. Είναι ένα μείγμα που αποτελείται κυρίως από διβασικό υποχλωριώδες ασβέστιο Ca3(OCl)2(OH)4, υποχλωριώδες ασβέστιο Ca(OCl)2 και διβασικό χλωριούχο ασβέστιο Ca3Cl2(OH)4. Σχηματίζεται από ελαφρώς υγρό σβησμένο ασβέστη.