Παραδείγματα αερίων – Τι είναι ένα αέριο;
Ένααέριο είναι μια κατάσταση της ύλης που δεν έχει σταθερό όγκο ή σχήμα. Με άλλα λόγια, ένα αέριο παίρνει το σχήμα και τον όγκο του δοχείου του. Τα αέρια συμπυκνώνονται σε υγρά ή ιονίζονται σε πλάσμα. Τα σωματίδια σε ένα αέριο είναι πιο μακριά το ένα από το άλλο παρά στα υγρά. Τα σωματίδια αερίου μπορεί να είναι στοιχεία ή ενώσεις. Ένα αέριο μπορεί να είναι είτε καθαρή ουσία (π.χ. οξυγόνο, ήλιο, διοξείδιο του άνθρακα) είτε μείγμα (π.χ. αέρας, φυσικό αέριο).
Παραδείγματα αερίων
Ακολουθούν παραδείγματα αερίων:
- Ακετυλένιο
- Αέρας
- Αργόν
- Διοξείδιο του άνθρακα
- Μονοξείδιο του άνθρακα
- Ήλιο
- Φυσικό αέριο
- Νέον
- Άζωτο
- Οξυγόνο
- Όζον
- Προπάνιο
- Υδρατμοί
Στοιχεία που είναι αέρια σε θερμοκρασία δωματίου
Πολλά στοιχεία είναι αέρια σε θερμοκρασία δωματίου και συνηθισμένη πίεση. Το υδρογόνο, το άζωτο, το οξυγόνο, το φθόριο και το χλώριο σχηματίζουν ομοπύρηνα διατομικά αέρια. Το οξυγόνο σχηματίζει επίσης το ομοπυρηνικό τριατομικό αέριο, το όζον. Όλα τα ευγενή αέρια (ήλιο, νέον, αργό, κρυπτόν, ξένον, ραδόνιο) είναι μονατομικά αέρια, εκτός από το ογκανεσσόν. Αν και το oganesson (στοιχείο 118) ανήκει στην ομάδα των ευγενών αερίων, είναι πιθανό να είναι στερεό σε θερμοκρασία δωματίου.
- Υδρογόνο (H2)
- Ήλιο (Αυτός)
- Άζωτο (N2)
- Οξυγόνο (O2)
- Όζον (O3)
- Φθόριο (Fl2)
- Νέον (Ne)
- Χλώριο (Br2)
- Αργόν (Ar)
- Krypton (Kr)
- Xenon (Xe)
- Ραδόνιο (Rn)
Αέριο έναντι ατμού
Μερικές φορές ο όρος "ατμός" χρησιμοποιείται για να περιγράψει ένα αέριο. Συνήθως, ο ατμός αναφέρεται στην αέρια μορφή μιας ουσίας που κανονικά βρίσκεται σε άλλη κατάσταση. Για παράδειγμα, το νερό είναι συνήθως ένα υγρό σε θερμοκρασία και πίεση δωματίου. Η αέρια μορφή του ονομάζεται υδρατμός.
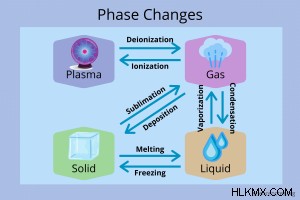
Αλλαγές φάσης που αφορούν αέρια
Τα αέρια μετατρέπονται σε πλάσμα, υγρά και αέρια. Μάθετε για τις διαφορετικές μεταβάσεις.
Διαφορά μεταξύ Ideal Gas και Real Gas
Η χημεία και η φυσική κάνουν διάκριση μεταξύ ιδανικών αερίων και πραγματικών αερίων. Ένα ιδανικό αέριο συμπεριφέρεται σύμφωνα με την κινητική-μοριακή θεωρία των αερίων και συμπεριφέρεται σύμφωνα με τον νόμο του ιδανικού αερίου. Ουσιαστικά, αυτό σημαίνει ότι τα σωματίδια ενός ιδανικού αερίου δεν καταλαμβάνουν όγκο, δεν έλκονται μεταξύ τους και αλληλεπιδρούν με απόλυτα ελαστικές συγκρούσεις. Κανένα πραγματικό αέριο δεν είναι ιδανικό, αλλά κάτω από συνηθισμένες θερμοκρασίες και πιέσεις, η συμπεριφορά τους είναι αρκετά κοντά στο ιδανικό ώστε να μπορείτε να χρησιμοποιήσετε τον νόμο του ιδανικού αερίου για να προσεγγίσετε τη συμπεριφορά τους. Ωστόσο, σε χαμηλή θερμοκρασία ή υψηλή πίεση, τα πραγματικά αέρια αποκλίνουν πάρα πολύ από την ιδανική συμπεριφορά. Αυτό συμβαίνει επειδή τα μόρια αερίου με δύναμη υψηλής πίεσης μαζί και το μέγεθος των σωματιδίων τους έχει σημασία. Σε χαμηλές θερμοκρασίες, τα σωματίδια στερούνται αρκετής κινητικής ενέργειας για να συμπεριφέρονται ιδανικά. Αισθάνονται έλξη ο ένας για τον άλλον και δεν αναπηδούν ο ένας από τον άλλο με απόλυτα ελαστικές συγκρούσεις.
Αναφορές
- Haynes, W. M., ed. (2016). Εγχειρίδιο CRC Χημείας και Φυσικής (96η έκδ.). Boca Raton, Φλόριντα:CRC Press/Taylor and Francis. ISBN 978-1482260960.
- John, James (1984). Gas Dynamics . Άλιν και Μπέικον. ISBN 978-0-205-08014-4.




