Πώς να σχεδιάσετε μια δομή Lewis
Η δομή Lewis είναι ένα διάγραμμα που δείχνει τους χημικούς δεσμούς μεταξύ των ατόμων σε ένα μόριο και των ηλεκτρονίων σθένους ή των μεμονωμένων ζευγών ηλεκτρονίων. Το διάγραμμα ονομάζεται επίσης διάγραμμα κουκκίδων Lewis, τύπος κουκκίδων Lewis ή διάγραμμα κουκκίδων ηλεκτρονίων. Οι δομές Lewis πήραν το όνομά τους από τον Gilbert N. Lewis, ο οποίος εισήγαγε τη θεωρία του δεσμού σθένους και τις δομές κουκκίδων στο άρθρο του 1916 Το άτομο και το μόριο .
Μια δομή Lewis δείχνει πώς τα ηλεκτρόνια είναι διατεταγμένα γύρω από τα άτομα, αλλά δεν εξηγεί πώς μοιράζονται τα ηλεκτρόνια μεταξύ των ατόμων, πώς σχηματίζονται χημικοί δεσμοί ή ποια είναι η γεωμετρία ενός μορίου. Δείτε πώς μπορείτε να σχεδιάσετε μια δομή Lewis, με παραδείγματα και μια ματιά τόσο στη σημασία όσο και στους περιορισμούς των διαγραμμάτων.
Μέρη μιας δομής Lewis
Οι δομές Lewis σχεδιάζονται για μόρια και σύμπλοκα. Μια δομή Lewis αποτελείται από τα ακόλουθα μέρη:
- Σύμβολα στοιχείων
- Τελεία που υποδεικνύουν ηλεκτρόνια σθένους
- Γραμμές που υποδεικνύουν χημικούς δεσμούς (μία γραμμή για έναν απλό δεσμό, δύο για έναν διπλό δεσμό κ.λπ.)
- Οι τελείες και οι γραμμές ικανοποιούν τον κανόνα της οκτάδας.
- Εάν η δομή φέρει καθαρό φορτίο, οι αγκύλες την περικλείουν και η χρέωση αναγράφεται στην επάνω δεξιά γωνία
Σημείωση:Μερικές φορές οι όροι "δομή Lewis" και "δομή ηλεκτρονίων κουκίδων" χρησιμοποιούνται εναλλακτικά. Τεχνικά, είναι λίγο διαφορετικά. Μια δομή Lewis χρησιμοποιεί γραμμές για να υποδείξει χημικούς δεσμούς, ενώ μια δομή ηλεκτρονίων κουκκίδων χρησιμοποιεί μόνο κουκκίδες.
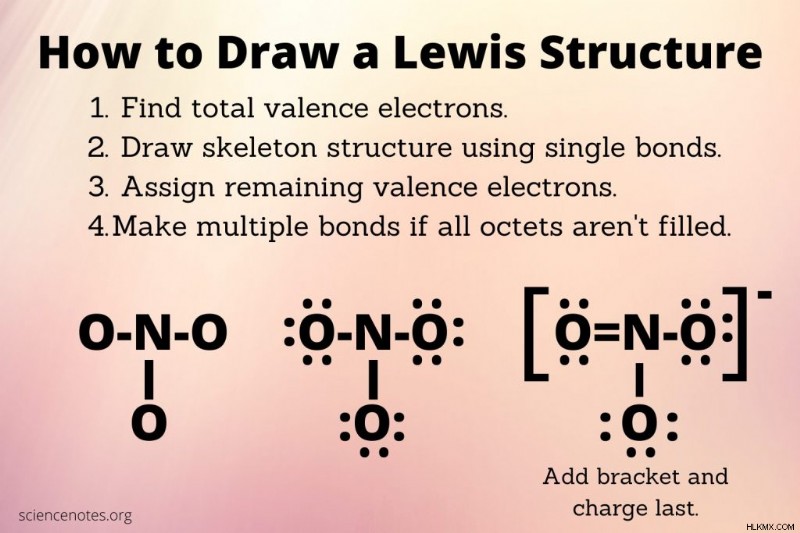
Βήματα για να σχεδιάσετε μια δομή Lewis
Υπάρχουν μόνο μερικά βήματα για να σχεδιάσετε μια δομή Lewis, αλλά μπορεί να χρειαστούν κάποιες δοκιμές και σφάλματα για να γίνει σωστά.
- Βρείτε τον συνολικό αριθμό ηλεκτρονίων σθένους για όλα τα άτομα του μορίου. Για ένα ουδέτερο μόριο, αυτό είναι το άθροισμα των ηλεκτρονίων σθένους σε κάθε άτομο. Ο αριθμός των ηλεκτρονίων σθένους για ένα στοιχείο είναι συνήθως ο ίδιος με τον αριθμό της ομάδας του στον περιοδικό πίνακα (εκτός από το ήλιο και τα μέταλλα). Εάν το μόριο έχει φορτίο, αφαιρέστε ένα ηλεκτρόνιο για κάθε θετικό φορτίο ή προσθέστε ένα ηλεκτρόνιο για κάθε αρνητικό φορτίο. Για παράδειγμα, για ΟΧΙ3 , έχετε 5 ηλεκτρόνια για το άτομο αζώτου και 3 x 6 =18 ηλεκτρόνια για τα άτομα οξυγόνου, συν ένα ηλεκτρόνιο σθένους για το καθαρό φορτίο, δίνοντας συνολικά 24 ηλεκτρόνια σθένους (5 + 18 + 1).
- Σχεδιάστε τη δομή του σκελετού του μορίου. Σε αυτό το σημείο, ας υποθέσουμε ότι τα άτομα συνδέονται με απλούς δεσμούς. Συνήθως, το άτομο που έχει τις περισσότερες θέσεις σύνδεσης είναι το κεντρικό άτομο (άρα ο άνθρακας θα ήταν κεντρικός έναντι του οξυγόνου).
- Προσδιορίστε πόσα ηλεκτρόνια χρειάζονται για να ικανοποιηθεί ο κανόνας της οκτάδας. Το κέλυφος ηλεκτρονίων σθένους υδρογόνου και ηλίου γεμίζει με 2 ηλεκτρόνια. Για άλλα άτομα, μέχρι την περίοδο 4 του περιοδικού πίνακα, το κέλυφος σθένους γεμίζει με 8 ηλεκτρόνια. Κάθε χημικός δεσμός απαιτεί δύο ηλεκτρόνια, επομένως χρησιμοποιήστε δύο ηλεκτρόνια σθένους για να σχηματίσετε κάθε δεσμό μεταξύ ατόμων στη δομή του σκελετού. Για ΟΧΙ3 , 6 ηλεκτρόνια χρησιμοποιήθηκαν για τη σχεδίαση των απλών δεσμών για τον σκελετό. Άρα, μένουν 18 ηλεκτρόνια. Ξεκινώντας με το πιο ηλεκτραρνητικό άτομο, κατανείμετε αυτά τα ηλεκτρόνια για να προσπαθήσετε να γεμίσετε τις οκτάδες των ατόμων.
- Κατανείμετε τα υπόλοιπα ηλεκτρόνια σθένους. Σχεδιάστε αυτά τα μη δεσμευτικά ηλεκτρόνια ως κουκκίδες γύρω από τα άτομα για να ικανοποιήσετε τον κανόνα της οκτάδας.
- Σχεδιάστε τους χημικούς δεσμούς στο μόριο. Εάν όλες οι οκτάδες δεν είναι γεμάτες, δημιουργήστε διπλούς ή τριπλούς δεσμούς. Για να το κάνετε αυτό, χρησιμοποιήστε ένα μεμονωμένο ζεύγος ηλεκτρονίων σε ένα ηλεκτραρνητικό άτομο και μετατρέψτε το σε ένα ζεύγος δεσμών κοινό με ένα ηλεκτροθετικό άτομο που δεν έχει ηλεκτρόνια.
- Ελέγξτε για να βεβαιωθείτε ότι έχετε τη χαμηλότερη επίσημη χρέωση για κάθε άτομο. Μην παραβιάζετε τον κανόνα της οκτάδας. Το επίσημο φορτίο είναι ο αριθμός των ηλεκτρονίων σθένους, μείον το ήμισυ του αριθμού των ηλεκτρονίων δεσμού, μείον τον αριθμό των μόνων ηλεκτρονίων. Άρα, για κάθε οξυγόνο μονού δεσμού είναι 6 – 1 – 6 =-1. για το άζωτο είναι 5 – 4 – 0 =+1. για το οξυγόνο με διπλούς δεσμούς είναι 6 – 2 – 4 =0. Υπάρχουν δύο άτομα οξυγόνου με μονό δεσμό, ένα άζωτο και ένα οξυγόνο με διπλούς δεσμούς, οπότε το καθαρό τυπικό φορτίο είναι -1 + -1 + 1 + 0 =-1. Είτε υποδεικνύετε τις επίσημες χρεώσεις ξεχωριστά είτε σχεδιάστε μια παρένθεση γύρω από τη δομή και προσθέστε – ή -1 ως εκθέτη.
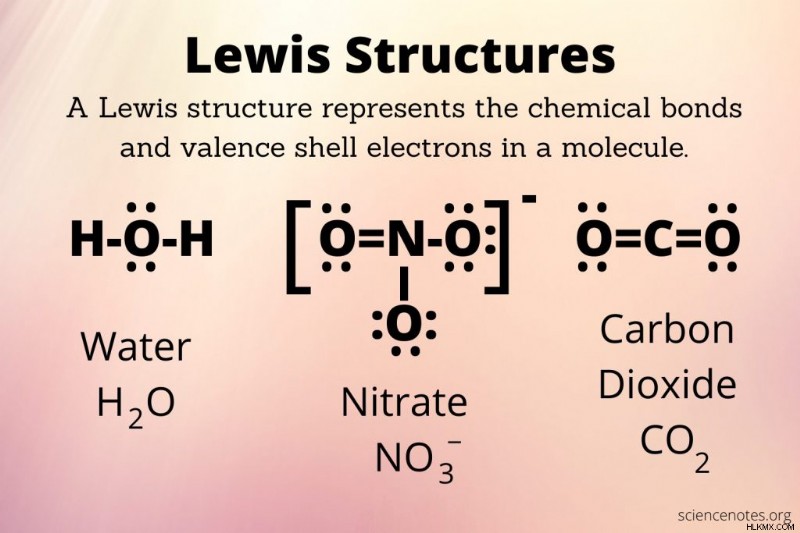
Διαφορετικοί τρόποι σχεδίασης δομών Lewis
Υπάρχουν περισσότεροι από ένας «σωστοί» τρόποι για να σχεδιάσετε μια δομή Lewis. Εάν σχεδιάζετε τις δομές για ένα μάθημα χημείας, φροντίστε να γνωρίζετε τι περιμένει ο εκπαιδευτής σας. Για παράδειγμα, ορισμένοι χημικοί προτιμούν να βλέπουν σκελετικές δομές που δεν δείχνουν καμία γεωμετρία, ενώ άλλοι προτιμούν να βλέπουν σχήματα (π.χ. το λυγισμένο σχήμα του νερού, με μη δεσμευτικά ζεύγη ηλεκτρονίων σε γωνία στη μία πλευρά του ατόμου οξυγόνου). Σε μερικούς αρέσει να βλέπουν τα άτομα και τα ηλεκτρόνια τους με χρώμα (π.χ. το οξυγόνο και τα ηλεκτρόνια του με κόκκινο χρώμα, τον άνθρακα και τα άτομά του με μαύρο χρώμα).
Γιατί οι δομές Lewis είναι σημαντικές
Οι δομές Lewis βοηθούν στην περιγραφή του σθένους, των χημικών δεσμών και των καταστάσεων οξείδωσης επειδή πολλά άτομα γεμίζουν ή μισογεμίζουν το κέλυφος σθένους τους. Η συμπεριφορά που περιγράφεται από τις δομές προσεγγίζει πολύ την πραγματική συμπεριφορά ελαφρύτερων στοιχείων, τα οποία έχουν οκτώ ηλεκτρόνια σθένους. Έτσι, είναι ιδιαίτερα χρήσιμα στην οργανική χημεία και τη βιοχημεία, η οποία βασίζεται στη συμπεριφορά του άνθρακα, του υδρογόνου και του οξυγόνου. Αν και οι δομές Lewis δεν δείχνουν απαραίτητα γεωμετρία, χρησιμοποιούνται για την πρόβλεψη της γεωμετρίας, της αντιδραστικότητας και της πολικότητας.
Περιορισμοί των δομών Lewis
Αν και είναι χρήσιμες για ορισμένες εφαρμογές, οι δομές Lewis δεν είναι τέλειες. Δεν λειτουργούν καλά όταν τα μόρια περιέχουν άτομα με περισσότερα από οκτώ ηλεκτρόνια σθένους, όπως οι λανθανίδες και οι ακτινίδες. Οι ανόργανες και οργανομεταλλικές ενώσεις χρησιμοποιούν σχήματα δεσμών πέρα από αυτά που περιγράφονται από τις δομές Lewis. Συγκεκριμένα, τα μοριακά τροχιακά μπορεί να είναι πλήρως μετατοπισμένα. Οι δομές Lewis δεν λαμβάνουν υπόψη την αρωματικότητα. Ακόμη και με ελαφρύτερα μόρια (O2 , ClO2 , ΟΧΙ), οι προβλεπόμενες δομές διαφέρουν αρκετά από την πραγματική συμπεριφορά που οι δομές Lewis μπορεί να οδηγήσουν σε εσφαλμένες προβλέψεις σχετικά με το μήκος του δεσμού, τις μαγνητικές ιδιότητες και τις τάξεις δεσμών.
Αναφορές
- IUPAC (1997). «Φόρμουλα Lewis». Σύνοψη Χημικής Ορολογίας (το «Χρυσό Βιβλίο») (2η έκδ.). Επιστημονικές Εκδόσεις Blackwell. ISBN 0-9678550-9-8.
- Lewis, G. N. (1916), «The Atom and the Molecule». J. Είμαι. Chem. Soc . 38 (4):762–85. doi:10.1021/ja02261a002
- Miburo, Barnabe B. (1993). «Απλοποιημένο Σχέδιο Δομής Lewis για Μη Επιστημονικές Επιστήμες». J. Chem. Εκπαιδεύω . 75 (3):317. doi:10.1021/ed075p317
- Zumdahl, S. (2005) Chemical Principles . Houghton-Mifflin. ISBN 0-618-37206-7.




