Διαμόρφωση ευγενούς αερίου – Διαμόρφωση ηλεκτρονίων συντομογραφίας
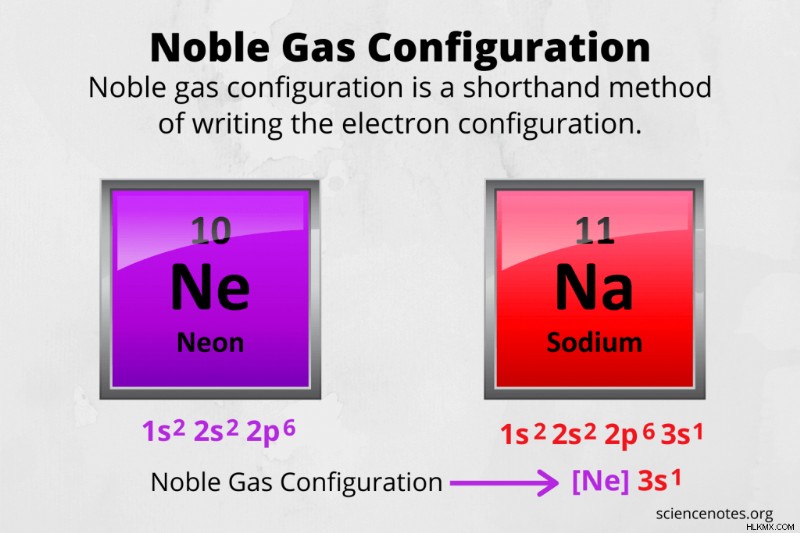
Στη χημεία, η διάταξη ευγενών αερίων είναι μια συνοπτική μέθοδος γραφής της διαμόρφωσης ηλεκτρονίων ενός ατόμου. Ο λόγος για τη χρήση της διαμόρφωσης ευγενών αερίων είναι επειδή η πλήρης διαμόρφωση ηλεκτρονίων γίνεται πολύ μεγάλη για άτομα με υψηλούς ατομικούς αριθμούς.
Ακολουθεί μια ματιά στο πώς μπορείτε να γράψετε μια διαμόρφωση ευγενών αερίων και μια λίστα με τις διαμορφώσεις ηλεκτρονίων και για τα 118 στοιχεία.
Πώς να γράψετε μια διαμόρφωση Noble Gas
Η διαμόρφωση ευγενούς αερίου δίνει τον πυρήνα ευγενούς αερίου που εμφανίζεται πριν από το στοιχείο στον περιοδικό πίνακα και στη συνέχεια τη διαμόρφωση ηλεκτρονίων των ηλεκτρονίων σθένους του ατόμου. Ωστόσο, πρέπει να κατανοήσετε πώς να γράψετε την πλήρη διαμόρφωση ηλεκτρονίων για να βρείτε τον αριθμό των ηλεκτρονίων σθένους.
Ακολουθούν τα βήματα για τη σύνταξη μιας διαμόρφωσης ευγενούς αερίου:
- Βρείτε τον αριθμό των ηλεκτρονίων για το άτομο. Για ένα ουδέτερο άτομο, αυτός είναι ο ίδιος με τον ατομικό αριθμό. (Για ένα ιόν, ο αριθμός των ηλεκτρονίων δεν είναι ίδιος με τον αριθμό των πρωτονίων, αλλά διαφορετικά ισχύουν τα ίδια βήματα.)
- Γεμίστε τα ηλεκτρονιακά κελύφη και τα ενεργειακά επίπεδα με τα ηλεκτρόνια.
Κάθε φλοιός χωρά έως και 2 ηλεκτρόνια.
Κάθε φλοιός p χωράει έως και 6 ηλεκτρόνια.
Κάθε d κέλυφος περιέχει έως και 10 ηλεκτρόνια.
Κάθε φλοιός f περιέχει έως και 14 ηλεκτρόνια.
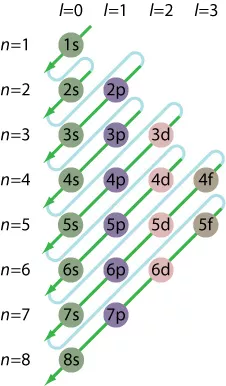
- Ακολουθήστε τον κανόνα Aufbau και γράψτε την πλήρη διαμόρφωση ηλεκτρονίων. Η αρχή Aufbau δηλώνει ότι τα ηλεκτρόνια γεμίζουν χαμηλότερα επίπεδα ενέργειας πριν προστεθούν σε υψηλότερα επίπεδα ενέργειας. Ενώ μπορείτε να χρησιμοποιήσετε ωμή βία για να γράψετε τη διαμόρφωση, είναι πιο εύκολο να σχεδιάσετε ένα διάγραμμα και να ακολουθήσετε τη διαγώνιο:
1s
2s 2p
3s 3p 3d
4s 4p 4d 4f
5s 5p 5d 5f
6s 6p 6d
7s 7p
8 δευτ
Παρατηρήστε ότι οι τροχιές επικαλύπτονται, ώστε να μην γεμίζετε απλώς τα κελύφη διαδοχικά (1, 2, 3, 4, ...). Αντίθετα, χρησιμοποιήστε τον κανόνα του Madelung:
1s <2s <2p <3s <3p <4s <3d <4p <5s <4d <5p <6s <4f <5d <6p <7s <5f <6d <7p
Σημείωση:Ο κανόνας του Madelung δεν είναι ένας αυστηρός κανόνας, ειδικά όταν πρόκειται για μερικά από τα βαρύτερα μέταλλα μετάπτωσης. Τα σχετικιστικά εφέ μπαίνουν στο παιχνίδι και αλλάζουν τη σειρά.
- Βρείτε το ευγενές αέριο που προηγείται του στοιχείου στον περιοδικό πίνακα. Γράψτε τη διαμόρφωση του ευγενούς αερίου γράφοντας τον πυρήνα του ευγενούς αερίου, ακολουθούμενο από τα ηλεκτρόνια σθένους. Ένας πυρήνας ευγενούς αερίου είναι το σύμβολο του στοιχείου ευγενούς αερίου που περικλείεται σε αγκύλες:[He], [Ne], [Ar], [Kr], [Xe] ή [Rn]. Τα ηλεκτρόνια σθένους είναι ηλεκτρόνια «υπολείμματα» που δεν γεμίζουν ένα κέλυφος ή δεν ικανοποιούν τον κανόνα της οκτάδας (εκτός από τα ευγενή αέρια) ή τον κανόνα των 18 ηλεκτρονίων (μέταλλα μετάπτωσης). Υπάρχουν δύο εύκολοι τρόποι για να τα αναγνωρίσετε. Τα ηλεκτρόνια σθένους είναι τα ηλεκτρόνια που απομένουν πέρα από τη διαμόρφωση ηλεκτρονίων ευγενούς αερίου. Είναι επίσης χαρακτηριστικά μιας ομάδας στοιχείων. Για παράδειγμα, τα αλκαλιμέταλλα έχουν πάντα 1 ηλεκτρόνιο σθένους.
Παραδείγματα διαμόρφωσης Noble Gas
Για παράδειγμα, γράψτε τη διαμόρφωση ευγενών αερίων του νατρίου.
- Ο ατομικός αριθμός του νατρίου είναι 11, επομένως γνωρίζετε ότι το ουδέτερο άτομο έχει 11 πρωτόνια και επίσης 11 ηλεκτρόνια.
- Η πλήρωση των φλοιών ηλεκτρονίων χρησιμοποιώντας την αρχή Aufbau δίνει μια διαμόρφωση 1s 2s sp 3s. Προσθέστε τους εκθέτες και ελέγξτε ξανά για να βεβαιωθείτε ότι έχετε τον σωστό αριθμό ηλεκτρονίων.
- Γράψτε τη διαμόρφωση ευγενούς αερίου. Κοιτάζοντας έναν περιοδικό πίνακα, σημειώστε το ευγενές αέριο πριν το νάτριο είναι νέον. Η διαμόρφωση ηλεκτρονίων του νέον είναι 1s 2s 2p. Έτσι, το σύμβολο του πυρήνα ευγενούς αερίου [Ne] αντικαθιστά αυτό το τμήμα της διαμόρφωσης ηλεκτρονίων νατρίου. Η διαμόρφωση ευγενών αερίων για το νάτριο είναι [Ne] 3s.
Για παράδειγμα, γράψτε τη διαμόρφωση ευγενούς αερίου του νέον.
- Το νέον είναι ένα ευγενές αέριο, αλλά μπορείτε να τα καταφέρετε καλύτερα από το να γράφετε απλώς [Ne] και να το αποκαλείτε καλό. Αρχικά, χρησιμοποιήστε τον περιοδικό πίνακα και δείτε ότι ο αριθμός των ηλεκτρονίων για ένα άτομο νέον είναι 10.
- Ακολουθήστε την αρχή Aufbau και γεμίστε κελύφη ηλεκτρονίων:1s 2s 2p
- Γράψτε τη διαμόρφωση ευγενούς αερίου χρησιμοποιώντας τον πυρήνα ευγενούς αερίου πριν από το νέον στον περιοδικό πίνακα, ακολουθούμενο από τα ηλεκτρόνια σθένους. Η διαμόρφωση ευγενούς αερίου του νέον είναι [He] 2s 2p. Παρατηρήστε ότι το σθένος του νέον είναι 8 (2 ηλεκτρόνια στο κέλυφος 2s και 6 ηλεκτρόνια στο κέλυφος 2p), που δείχνει ότι έχει μια γεμάτη οκτάδα.
Λίστα διαμορφώσεων Noble Gas για Και τα 118 Στοιχεία
| NUMBER | ΣΤΟΙΧΕΙΟ | ΔΙΑΜΟΡΦΩΣΗ ΗΛΕΚΤΡΟΝΙΟΥ |
| 1 | Υδρογόνο | 1s |
| 2 | Ήλιο | 1s |
| 3 | Λίθιο | [He]2s |
| 4 | Βηρύλλιο | [He]2s |
| 5 | Βόριο | [He]2s2p |
| 6 | Άνθρακας | [He]2s2p |
| 7 | Άζωτο | [He]2s2p |
| 8 | Οξυγόνο | [He]2s2p |
| 9 | Φθόριο | [He]2s2p |
| 10 | Νέον | [He]2s2p |
| 11 | Νάτριο | [Ne]3s |
| 12 | Μαγνήσιο | [Ne]3s |
| 13 | Αλουμίνιο | [Ne]3s3p |
| 14 | Πυρίτιο | [Ne]3s3p |
| 15 | Φώσφορος | [Ne]3s3p |
| 16 | Θείο | [Ne]3s3p |
| 17 | Χλώριο | [Ne]3s3p |
| 18 | Αργόν | [Ne]3s3p |
| 19 | Κάλιο | [Ar]4s |
| 20 | Ασβέστιο | [Ar]4s |
| 21 | Σκάνδιο | [Ar]3d4s |
| 22 | Τιτάνιο | [Ar]3d4s |
| 23 | Βανάδιο | [Ar]3d4s |
| 24 | Chromium | [Ar]3d4s |
| 25 | Μαγγάνιο | [Ar]3d4s |
| 26 | Σίδερο | [Ar]3d4s |
| 27 | Κοβάλτιο | [Ar]3d4s |
| 28 | Νίκελ | [Ar]3d4s |
| 29 | Χαλκός | [Ar]3d4s |
| 30 | Ψευδάργυρος | [Ar]3d4s |
| 31 | Γάλλιο | [Ar]3d4s4p |
| 32 | Γερμάνιο | [Ar]3d4s4p |
| 33 | Αρσενικό | [Ar]3d4s4p |
| 34 | Σελήνιο | [Ar]3d4s4p |
| 35 | Βρώμιο | [Ar]3d4s4p |
| 36 | Krypton | [Ar]3d4s4p |
| 37 | Ρουβίδιο | [Kr]5s |
| 38 | Στρόντιο | [Kr]5s |
| 39 | Ύττριο | [Kr]4d5s |
| 40 | Ζιρκόνιο | [Kr]4d5s |
| 41 | Νιόβιο | [Kr]4d5s |
| 42 | Μολυβδαίνιο | [Kr]4d5s |
| 43 | Τεχνήτιο | [Kr]4d5s |
| 44 | Ρουθήνιο | [Kr]4d5s |
| 45 | Ρόδιο | [Kr]4d5s |
| 46 | Παλλάδιο | [Kr]4d |
| 47 | Ασημί | [Kr]4d5s |
| 48 | Κάδμιο | [Kr]4d5s |
| 49 | Ίνδιο | [Kr]4d5s5p |
| 50 | Κασσίτερος | [Kr]4d5s5p |
| 51 | Αντιμόνιο | [Kr]4d5s5p |
| 52 | Τελλούριο | [Kr]4d5s5p |
| 53 | Ιώδιο | [Kr]4d5s5p |
| 54 | Xenon | [Kr]4d5s5p |
| 55 | Κάσιο | [Xe]6s |
| 56 | Βάριο | [Xe]6s |
| 57 | Λανθάνιο | [Xe]5d6s |
| 58 | Cerium | [Xe]4f5d6s |
| 59 | Πρασεοδύμιο | [Xe]4f6s |
| 60 | Νεοδύμιο | [Xe]4f6s |
| 61 | Προμέθιο | [Xe]4f6s |
| 62 | Σαμάριο | [Xe]4f6s |
| 63 | Ευρώπιο | [Xe]4f6s |
| 64 | Γαδολίνιο | [Xe]4f5d6s |
| 65 | Τέρβιο | [Xe]4f6s |
| 66 | Δυσπρόσιο | [Xe]4f6s |
| 67 | Χόλμιο | [Xe]4f6s |
| 68 | Έρβιο | [Xe]4f6s |
| 69 | Θούλιο | [Xe]4f6s |
| 70 | Υτέρβιο | [Xe]4f6s |
| 71 | Λουτέτιο | [Xe]4f5d6s |
| 72 | Hafnium | [Xe]4f5d6s |
| 73 | Ταντάλιο | [Xe]4f5d6s |
| 74 | Βολφράμιο | [Xe]4f5d6s |
| 75 | Ρήνιο | [Xe]4f5d6s |
| 76 | Όσμιο | [Xe]4f5d6s |
| 77 | Ιρίδιο | [Xe]4f5d6s |
| 78 | Πλατινένιο | [Xe]4f5d6s |
| 79 | Χρυσός | [Xe]4f5d6s |
| 80 | Ερμής | [Xe]4f5d6s |
| 81 | Θάλλιο | [Xe]4f5d6s6p |
| 82 | Προηγούμενος | [Xe]4f5d6s6p |
| 83 | Βισμούθιο | [Xe]4f5d6s6p |
| 84 | Πολώνιο | [Xe]4f5d6s6p |
| 85 | Αστατίνη | [Xe]4f5d6s6p |
| 86 | Ραδόνιο | [Xe]4f5d6s6p |
| 87 | Φράγκιο | [Rn]7s |
| 88 | Ράδιο | [Rn]7s |
| 89 | Ακτίνιο | [Rn]6d7s |
| 90 | Θόριο | [Rn]6d7s |
| 91 | Πρωτακτίνιο | [Rn]5f6d7s |
| 92 | Ουράνιο | [Rn]5f6d7s |
| 93 | Ποσειδώνιο | [Rn]5f6d7s |
| 94 | Πλουτώνιο | [Rn]5f7s |
| 95 | Americium | [Rn]5f7s |
| 96 | Κούριο | [Rn]5f6d7s |
| 97 | Βερκέλιο | [Rn]5f7s |
| 98 | Καλιφόρνιο | [Rn]5f7s |
| 99 | Αϊνστάιν | [Rn]5f7s |
| 100 | Φέρμιο | [Rn]5f7s |
| 101 | Μεντελέβιο | [Rn]5f7s |
| 102 | Nobelium | [Rn]5f7s |
| 103 | Λαυρένιο | [Rn]5f7s7p |
| 104 | Rutherfordium | [Rn]5f6d7s |
| 105 | Dubnium | *[Rn]5f6d7s |
| 106 | Seaborgium | *[Rn]5f6d7s |
| 107 | Βόριο | *[Rn]5f6d7s |
| 108 | Χάσιο | *[Rn]5f6d7s |
| 109 | Meitnerium | *[Rn]5f6d7s |
| 110 | Darmstadtium | *[Rn]5f6d7s |
| 111 | Roentgenium | *[Rn]5f6d7s |
| 112 | Κοπέρνιο | *[Rn]5f6d7s |
| 113 | Νιχόνιο | *[Rn]5f6d7s7p |
| 114 | Flerovium | *[Rn]5f6d7s7p |
| 115 | Μοσκόβιο | *[Rn]5f6d7s7p |
| 116 | Livermorium | *[Rn]5f6d7s7p |
| 117 | Τενεσί | *[Rn]5f6d7s7p |
| 118 | Oganesson | *[Rn]5f6d7s7p |
Αναφορές
- Dzikowski, K. D.; et al. (2021). «Σχετικό μοντέλο αποτελεσματικού φορτίου ενός ατόμου πολλαπλών ηλεκτρονίων». Journal of Physics B:Atomic, Molecular and Optical Physics 54 (11):115002. doi:10.1088/1361-6455/abdaca
- Langmuir, Irving (Ιούνιος 1919). «Η διάταξη των ηλεκτρονίων σε άτομα και μόρια». Journal of the American Chemical Society . 41 (6):868–934. doi:10.1021/ja02227a002
- Rayner-Canham, Geoff; Overton, Tina (2014). Περιγραφική Ανόργανη Χημεία (6η έκδ.). Macmillan Education. ISBN 978-1-319-15411-0.
- Stoner, E.C. (1924). «Η κατανομή των ηλεκτρονίων μεταξύ των ατομικών επιπέδων». Philosophical Magazine . 6η Σειρά. 48 (286):719–36. doi:10.1080/14786442408634535
- Wong, D. Pan (1979). «Θεωρητική αιτιολόγηση του κανόνα του Madelung». Journal of Chemical Education . 56 (11):714–18. doi:10.1021/ed056p714




