Νόμος Dalton της μερικής πίεσης - Ορισμός και παραδείγματα
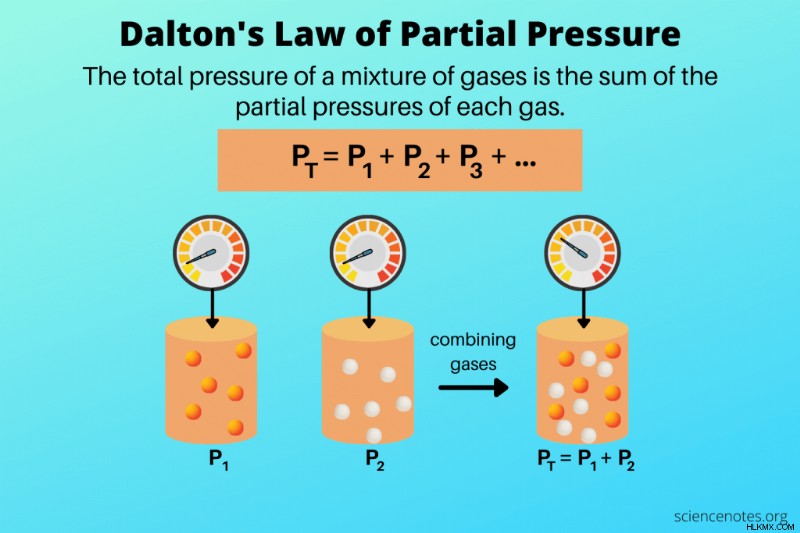
Νόμος μερικής πίεσης του Ντάλτον είναι ένας νόμος ιδανικών αερίων που δηλώνει ότι η συνολική πίεση ενός μείγματος αερίων είναι ίση με το άθροισμα των μερικών πιέσεων κάθε αερίου. Ο Άγγλος επιστήμονας John Dalton παρατήρησε τη συμπεριφορά των αερίων το 1801 και δημοσίευσε το νόμο των αερίων το 1802. Ενώ ο νόμος των μερικών πιέσεων του Dalton περιγράφει τα ιδανικά αέρια, τα πραγματικά αέρια ακολουθούν τον νόμο στις περισσότερες συνθήκες.
Τύπος νόμου του Ντάλτον
Ο τύπος του νόμου του Dalton δηλώνει ότι η πίεση ενός μείγματος αερίων είναι το άθροισμα των μερικών πιέσεων των συστατικών αερίων του:
PΤ =P1 + P2 + P3 + …
Εδώ, PT είναι η συνολική πίεση του μείγματος και P1 , P2 , κ.λπ. είναι οι μερικές πιέσεις των μεμονωμένων αερίων.
Επίλυση για μερική πίεση ή μοριακό κλάσμα
Ο συνδυασμός του νόμου του Dalton με τον νόμο του ιδανικού αερίου καθιστά δυνατή την επίλυση της μερικής πίεσης, του μοριακού κλάσματος ή του αριθμού γραμμομορίων ενός συστατικού του μείγματος αερίων.
Pi =PT ( ni / nΤ )
Εδώ, Pi είναι η μερική πίεση ενός μεμονωμένου αερίου, PT είναι η συνολική πίεση του μείγματος, ni είναι ο αριθμός των mol του αερίου και nT είναι ο συνολικός αριθμός γραμμομορίων όλων των αερίων στο μείγμα.
Μπορείτε να λύσετε για το κλάσμα γραμμομορίων, την πίεση ενός συστατικού ή τη συνολική πίεση, τον όγκο ενός συστατικού ή τον συνολικό όγκο και τον αριθμό των γραμμομορίων ενός συστατικού και τον συνολικό αριθμό γραμμομορίων αερίου:
Xi =Pi / PT =Vi / VT =ni / nΤ
Εδώ, Xi είναι το μοριακό κλάσμα ενός συστατικού (i) ενός μείγματος αερίων, το P είναι πίεση, το V είναι ο όγκος και το n είναι ο αριθμός των γραμμομορίων.
Υποθέσεις στον νόμο του Dalton για τη μερική πίεση
Ο νόμος του Dalton υποθέτει ότι τα αέρια συμπεριφέρονται ως ιδανικά αέρια:
- Η μερική πίεση ενός αερίου είναι η πίεση που ασκείται από ένα μεμονωμένο συστατικό σε ένα μείγμα αερίων.
- Τα μόρια αερίου ακολουθούν την κινητική θεωρία των αερίων. Με άλλα λόγια, συμπεριφέρονται ως σημειακές μάζες με αμελητέο όγκο που είναι ευρέως διαχωρισμένες μεταξύ τους, ούτε έλκονται ούτε απωθούνται το ένα από το άλλο και έχουν ελαστικές συγκρούσεις μεταξύ τους και τοιχώματα δοχείων.
Ο νόμος του Dalton προβλέπει τη συμπεριφορά του αερίου αρκετά καλά, αλλά τα πραγματικά αέρια αποκλίνουν από το νόμο καθώς αυξάνεται η πίεση. Σε υψηλή πίεση, υπάρχει λιγότερος χώρος μεταξύ των μορίων αερίου και οι αλληλεπιδράσεις μεταξύ τους γίνονται πιο σημαντικές.
Παραδείγματα νόμου του Ντάλτον και προβλήματα που λύθηκαν
Ακολουθούν παραδείγματα που δείχνουν πώς χρησιμοποιείτε το νόμο του Dalton για τη μερική πίεση:
Υπολογισμός μερικής πίεσης χρησιμοποιώντας το νόμο του Dalton
Για παράδειγμα, υπολογίστε τη μερική πίεση του αερίου οξυγόνου σε ένα μείγμα αζώτου, διοξειδίου του άνθρακα και οξυγόνου. Τα μείγματα έχουν συνολική πίεση 150 kPa και οι μερικές πιέσεις αζώτου και διοξειδίου του άνθρακα είναι 100 kPa και 24 kPa, αντίστοιχα.
Αυτή είναι μια απλή εφαρμογή του νόμου του Dalton:
PT =P1 + P2 + P3
Pσύνολο =Pάζωτο + Pδιοξείδιο του άνθρακα + Pοξυγόνο
150 kPa =100 kPa + 24 kPa + Pοξυγόνο
Pοξυγόνο =150 kPa – 100 kPa – 24kPa
Pοξυγόνο =26 kPa
Ελέγχετε πάντα την εργασία σας. Προσθέστε τις μερικές πιέσεις και βεβαιωθείτε ότι έχετε το σωστό σύνολο.
Υπολογισμός μοριακού κλάσματος με χρήση του νόμου του Dalton
Για παράδειγμα, βρείτε το μοριακό κλάσμα του οξυγόνου σε ένα μείγμα υδρογόνου και αερίου οξυγόνου. Η συνολική πίεση του μείγματος είναι 1,5 atm και η μερική πίεση του υδρογόνου είναι 1 atm.
Ξεκινήστε με το νόμο του Dalton και βρείτε τη μερική πίεση του αερίου οξυγόνου.
PT =P1 + P2
Pσύνολο =Pυδρογόνο + Pοξυγόνο
1,5 atm =1 atm + Pοξυγόνο
Pοξυγόνο =1,5 atm – 1 atm
Pοξυγόνο =0,5 atm
Στη συνέχεια, εφαρμόστε τον τύπο για το μοριακό κλάσμα.
Xi =Pi / PT
Xοξυγόνο =Pοξυγόνο /Pσύνολο
Xοξυγόνο =0,5/1,5 =0,33
Σημειώστε ότι το μοριακό κλάσμα είναι καθαρός αριθμός. Δεν έχει σημασία ποιες μονάδες πίεσης χρησιμοποιείτε, αρκεί να είναι ίδιες τόσο στον αριθμητή όσο και στον παρονομαστή του κλάσματος.
Συνδυασμός του νόμου του ιδανικού αερίου και του νόμου του Dalton
Πολλά προβλήματα του νόμου του Dalton απαιτούν ορισμένους υπολογισμούς χρησιμοποιώντας τον νόμο του ιδανικού αερίου. Για παράδειγμα, βρείτε τις μερικές πιέσεις και την ολική πίεση ενός μείγματος αερίου αζώτου και οξυγόνου. Το μείγμα σχηματίζεται συνδυάζοντας ένα δοχείο 24,0 L αζώτου (N2 ) αέριο σε 2 atm και ένα δοχείο 12,0 L οξυγόνου (O2 ) αέριο στα 2 atm. Το δοχείο έχει όγκο 10,0 L. Και τα δύο αέρια βρίσκονται σε απόλυτη θερμοκρασία 273 K.
Το πρόβλημα δίνει την πίεση (P), τον όγκο (V) και τη θερμοκρασία (T) για τα αέρια πριν σχηματιστεί το μείγμα, επομένως εφαρμόστε τον νόμο του ιδανικού αερίου για να βρείτε τον αριθμό των γραμμομορίων (n) κάθε αερίου.
PV =nRT
Αναδιάταξη του νόμου του ιδανικού αερίου και επίλυση του αριθμού των γραμμομορίων. Βεβαιωθείτε ότι χρησιμοποιείτε τις κατάλληλες μονάδες για την ιδανική σταθερά αερίου.
n =PV/RT
nN2 =(2 atm)(24,0 L)/(0,08206 atm· L/mol· Κ)(273 Κ) =2,14 mol N2
nO2 =(2 atm)(12,0 L)/(0,08206 atm· L/mol· Κ)(273 Κ) =1,07 mol O2
Στη συνέχεια, βρείτε τις μερικές πιέσεις κάθε αερίου αφού αναμειχθούν. Ο όγκος του μείγματος είναι διαφορετικός από τους αρχικούς όγκους των αερίων, επομένως γνωρίζετε ότι η πίεση του μείγματος είναι διαφορετική από τις αρχικές πιέσεις. Αυτή τη φορά, χρησιμοποιήστε τον νόμο του ιδανικού αερίου, αλλά λύστε την πίεση.
PV =nRT
P =nRT/V
PN2 =(2,14 mol) (0,08206 atm· L/mol· K)(273 K) / 10 L =4,79 atm
PO2 =(1,07 mol) (0,08206 atm· L/mol· K)(273 K) / 10 L =2,40 atm
Οι μερικές πιέσεις κάθε αερίου στο μείγμα είναι υψηλότερες από τις αρχικές τους πιέσεις. Αυτό είναι λογικό, καθώς η πίεση είναι αντιστρόφως ανάλογη του όγκου.
Τώρα, εφαρμόστε το νόμο του Dalton και λύστε τη συνολική πίεση του μείγματος.
PT =P1 + P2
PT =PN2 + PO2 =4,79 atm + 2,40 atm =7,19 atm
Δεδομένου ότι ο νόμος του Dalton και ο νόμος του ιδανικού αερίου κάνουν τις ίδιες υποθέσεις σχετικά με τη συμπεριφορά των αερίων, λαμβάνετε την ίδια απάντηση απλώς συνδέοντας το άθροισμα του αριθμού των γραμμομορίων αερίου στον νόμο του ιδανικού αερίου.
PT =(nN2 + nO2 )RT/V
PT =(2,14 mol + 1,07 mol) (0,08206 atm· L/mol· K)(273 K) / 10 L =7,19 atm
Αναφορές
- Adkins, C. J. (1983). Θερμοδυναμική Ισορροπίας (3η έκδ.). Cambridge, UK:Cambridge University Press. ISBN 0-521-25445-0.
- Calvert, J. G. (1990). «Γλωσσάρι όρων ατμοσφαιρικής χημείας (Recommendations 1990)». Καθαρή και Εφαρμοσμένη Χημεία . 62 (11):2167–2219. doi:10.1351/pac199062112167
- Dalton, J. (1802). «Δοκίμιο IV. Σχετικά με τη διαστολή των ελαστικών ρευστών με τη θερμότητα.» Απομνημονεύματα της Λογοτεχνικής και Φιλοσοφικής Εταιρείας του Μάντσεστερ . Τομ. 5, σημ. 2:595–602.
- Silberberg, Martin S. (2009). Χημεία:Η μοριακή φύση της ύλης και της αλλαγής (5η έκδ.). Βοστώνη:McGraw-Hill. ISBN 9780073048598.
- Tuckerman, Mark E. (2010). Στατιστική Μηχανική:Θεωρία και Μοριακή Προσομοίωση (1η έκδ.). ISBN 978-0-19-852526-4.




