Διαφορά μεταξύ ηλεκτροχημικών κυψελών και ηλεκτρολυτικών κυψελών
Κύρια διαφορά – Ηλεκτροχημικό στοιχείο έναντι ηλεκτρολυτικού κυττάρου
Η Ηλεκτροχημεία περιλαμβάνει τη μελέτη της κίνησης των ηλεκτρονίων σε συστήματα όπου λαμβάνουν χώρα χημικές διεργασίες. Εδώ, οι χημικές αντιδράσεις μπορούν να χρησιμοποιηθούν για τη δημιουργία ηλεκτρικού ρεύματος ή ένα ηλεκτρικό ρεύμα μπορεί να χρησιμοποιηθεί για να διευκολυνθεί η εμφάνιση μιας μη αυθόρμητης χημικής αντίδρασης. Και με τους δύο τρόπους, θα συμβεί η μετατροπή της ηλεκτρικής ενέργειας σε χημική ενέργεια ή το αντίθετο. Τα συστήματα όπου λαμβάνουν χώρα αυτές οι μετατροπές είναι γνωστά ως κύτταρα ή, ακριβέστερα, ηλεκτροχημικά κύτταρα. Υπάρχουν δύο τύποι ηλεκτροχημικών στοιχείων γνωστά ως βολταϊκά στοιχεία και ηλεκτρολυτικά στοιχεία. Η κύρια διαφορά μεταξύ του ηλεκτροχημικού στοιχείου και του ηλεκτρολυτικού στοιχείου είναι ότι το ηλεκτροχημικό στοιχείο δεν χρειάζεται εξωτερικό ρεύμα για λειτουργία ενώ τα ηλεκτρολυτικά κύτταρα χρειάζονται εξωτερικό ρεύμα για να λειτουργήσουν.
Βασικές περιοχές που καλύπτονται
1. Τι είναι το Ηλεκτροχημικό Κύτταρο
– Ορισμός, Ιδιότητες, Πώς λειτουργεί
2. Τι είναι το Ηλεκτρολυτικό Κύτταρο
– Ορισμός, Ιδιότητες, Πώς λειτουργεί
3. Ποια είναι η διαφορά μεταξύ ηλεκτροχημικού κυττάρου και ηλεκτρολυτικού κυττάρου
– Σύγκριση βασικών διαφορών
Βασικοί όροι:άνοδος, κάθοδος, ηλεκτροχημικό στοιχείο, ηλεκτρόλυση, ηλεκτρολυτικό στοιχείο, γαλβανικό στοιχείο, οξείδωση, αναγωγή, βολταϊκό στοιχείο 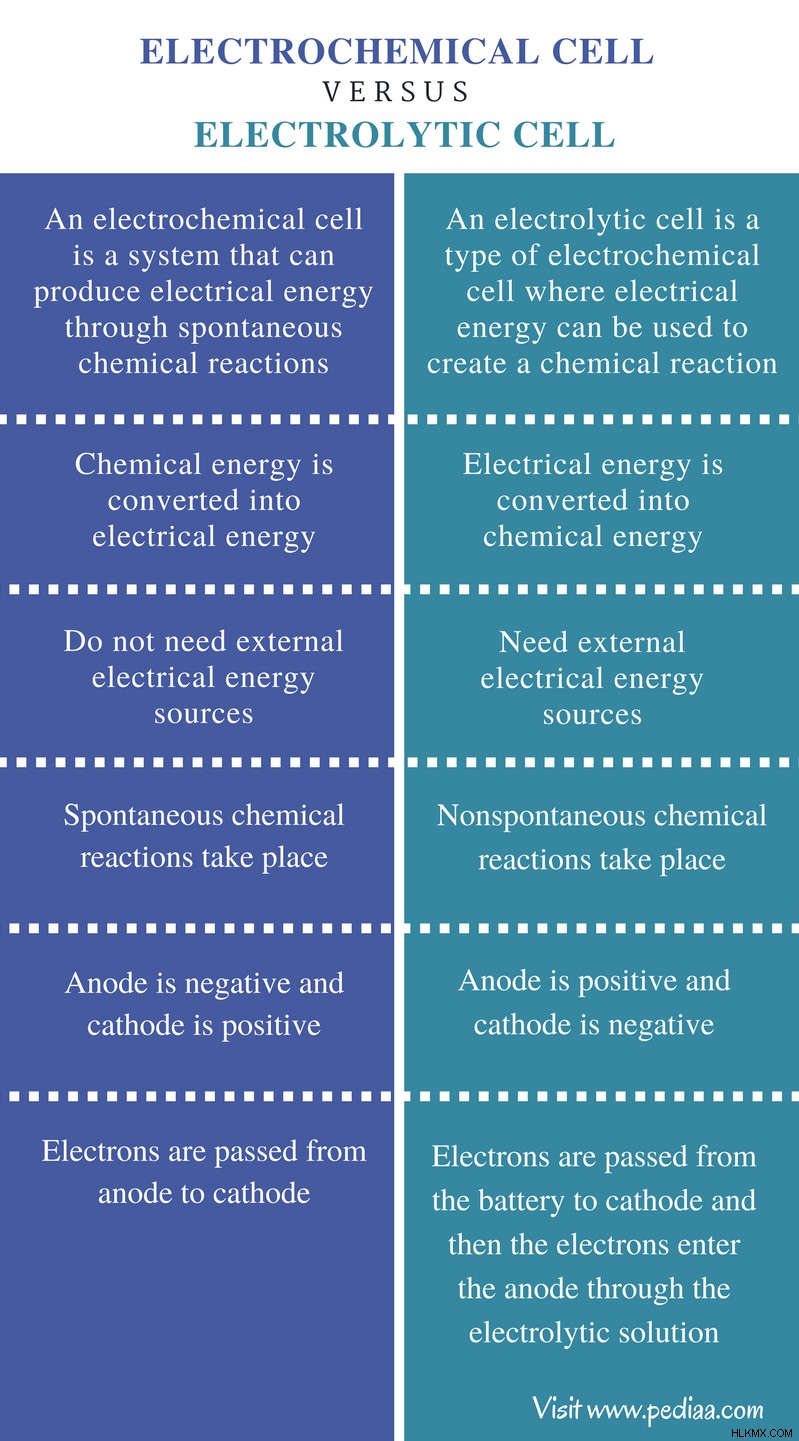
Τι είναι ένα Ηλεκτροχημικό Κύτταρο
Ένα ηλεκτροχημικό στοιχείο είναι ένα σύστημα που μπορεί να παράγει ηλεκτρική ενέργεια μέσω αυθόρμητων χημικών αντιδράσεων. Οι χημικές αντιδράσεις που εμπλέκονται σε αυτή τη διαδικασία ονομάζονται αντιδράσεις οξειδοαναγωγής. Οι αντιδράσεις οξειδοαναγωγής συμβαίνουν μέσω της μεταφοράς ηλεκτρονίων μεταξύ χημικών ειδών. Μια αντίδραση οξειδοαναγωγής περιλαμβάνει δύο ημι-αντιδράσεις:αντίδραση οξείδωσης και αντίδραση αναγωγής. Η αντίδραση οξείδωσης απελευθερώνει πάντα ηλεκτρόνια στο σύστημα, ενώ η αντίδραση αναγωγής παίρνει ηλεκτρόνια από το σύστημα. Επομένως, οι δύο ημι-αντιδράσεις συμβαίνουν ταυτόχρονα.
Τα ηλεκτροχημικά κύτταρα βρίσκονται σε δύο τύπους, όπως τα βολταϊκά (γαλβανικά) και τα ηλεκτρολυτικά στοιχεία. Ένα ηλεκτροχημικό στοιχείο αποτελείται από δύο μισά στοιχεία. Οι ημι-αντιδράσεις συμβαίνουν σε δύο μισά κύτταρα. Οι χημικές αντιδράσεις που λαμβάνουν χώρα σε αυτό το κύτταρο προκαλούν τη δημιουργία διαφοράς δυναμικού μεταξύ δύο μισών κυττάρων.
Ένα μισό στοιχείο πρέπει να αποτελείται από ένα ηλεκτρόδιο και έναν ηλεκτρολύτη. Επομένως, ένα πλήρες ηλεκτροχημικό στοιχείο αποτελείται από δύο ηλεκτρόδια και δύο ηλεκτρολύτες. Μερικές φορές, τα δύο μισά κύτταρα μπορεί να χρησιμοποιούν τον ίδιο ηλεκτρολύτη. Εάν χρησιμοποιούνται δύο διαφορετικοί ηλεκτρολύτες, τότε θα πρέπει να χρησιμοποιηθεί μια γέφυρα αλατιού για να διατηρείται η επαφή μεταξύ των ηλεκτρολυτών. Γίνεται κάνοντας ένα πέρασμα για τη μεταφορά ιόντων μέσω της γέφυρας αλατιού. Τα ηλεκτρόνια ρέουν από το ένα μισό στοιχείο στο άλλο μέσω ενός εξωτερικού κυκλώματος. Τα δύο ηλεκτρόδια ονομάζονται άνοδος και κάθοδος.
Οι αντιδράσεις οξείδωσης και αναγωγής συμβαίνουν σε δύο ηλεκτρόδια χωριστά. Η αντίδραση οξείδωσης συμβαίνει στην άνοδο ενώ η αντίδραση αναγωγής στην κάθοδο. Επομένως, παράγονται ηλεκτρόνια στην άνοδο και μετακινούνται από άνοδο σε κάθοδο μέσω του εξωτερικού κυκλώματος. Η γέφυρα αλατιού βοηθά στη διατήρηση του συστήματος ουδέτερο (ηλεκτρικά) μεταφέροντας ιόντα μέσω αυτής προκειμένου να εξισορροπηθούν τα ηλεκτρικά φορτία.
Ας εξετάσουμε το ακόλουθο ηλεκτροχημικό στοιχείο.
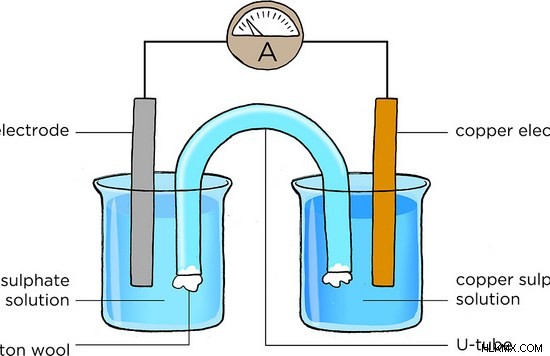
Εικόνα 1:Ηλεκτροχημικό στοιχείο
Εδώ, η άνοδος είναι το ηλεκτρόδιο Zn (Ψευδάργυρος) και η κάθοδος είναι το ηλεκτρόδιο Cu (Χαλκού). Η αντίδραση οξείδωσης συμβαίνει στο ηλεκτρόδιο Zn. Εκεί, ο μεταλλικός Zn οξειδώνεται σε ιόντα Zn. Τα απελευθερωμένα ηλεκτρόνια περνούν μέσω του εξωτερικού σύρματος. Τα παραγόμενα ιόντα Zn απελευθερώνονται στο διάλυμα. Επομένως, το ηλεκτρόδιο Zn θα διαλυθεί με την πάροδο του χρόνου. Η αντίδραση αναγωγής λαμβάνει χώρα κοντά στην κάθοδο. Η κάθοδος είναι ένα ηλεκτρόδιο Cu. Εκεί, τα ηλεκτρόνια που προέρχονται από το εξωτερικό κύκλωμα λαμβάνονται από τα ιόντα Cu στο διάλυμα και ανάγονται σε μέταλλο Cu. Επομένως, η μάζα του ηλεκτροδίου Cu θα αυξηθεί με το χρόνο. Η ροή ηλεκτρονίων μέσω του εξωτερικού καλωδίου μπορεί να μετρηθεί ως το ηλεκτρικό ρεύμα που παράγεται από την αντίδραση οξειδοαναγωγής. Αυτή είναι η τυπική δομή ενός ηλεκτροχημικού στοιχείου.
Αντιδράσεις
- Αντίδραση στην άνοδο (οξείδωση)
Zn(s) → Zn(aq) + 2e
- Αντίδραση στην κάθοδο (αναγωγή)
Cu(aq) + 2e → Cu(s)
Τι είναι ένα Electrolytic Cell
Ένα ηλεκτρολυτικό στοιχείο είναι ένας τύπος ηλεκτροχημικού στοιχείου στο οποίο η ηλεκτρική ενέργεια μπορεί να χρησιμοποιηθεί για να προκαλέσει μια χημική αντίδραση. Με άλλα λόγια, η ηλεκτρική ενέργεια θα πρέπει να παρέχεται από εξωτερική πηγή. Τότε μπορεί να ξεκινήσει μια μη αυθόρμητη αντίδραση. Τα ηλεκτρολυτικά κύτταρα χρησιμοποιούνται συχνότερα για ηλεκτρόλυση ενώσεων.
Ένα ηλεκτρολυτικό στοιχείο αποτελείται επίσης από στερεά μέταλλα ως ηλεκτρόδια. Υπάρχουν δύο ηλεκτρόδια συνδεδεμένα σε ένα εξωτερικό κύκλωμα. Το ένα ηλεκτρόδιο δρα ως άνοδος ενώ το άλλο ως κάθοδος. Η αντίδραση οξείδωσης θα συμβεί στην άνοδο και η αντίδραση αναγωγής στην κάθοδο.
Η εξωτερική παροχή ηλεκτρικής ενέργειας (από την μπαταρία που είναι συνδεδεμένη στα δύο ηλεκτρόδια) παρέχει μια ροή ηλεκτρονίων μέσω της καθόδου. Αυτά τα ηλεκτρόνια εισέρχονται στη συνέχεια στο ηλεκτρολυτικό διάλυμα. Στη συνέχεια, τα κατιόντα στο διάλυμα συγκεντρώνονται γύρω από την κάθοδο και λαμβάνουν ηλεκτρόνια που διέρχονται από την κάθοδο. Επομένως, αυτά τα κατιόντα μειώνονται στην κάθοδο. Τα ηλεκτρόνια στην κάθοδο απωθούν τα ανιόντα στο διάλυμα. Αυτά τα ανιόντα μεταναστεύουν προς την άνοδο. Εκεί, αυτά τα ανιόντα απελευθερώνουν ηλεκτρόνια και οξειδώνονται. Επομένως, η άνοδος έχει θετικό φορτίο και η κάθοδος έχει αρνητικό φορτίο.
Ας εξετάσουμε το ακόλουθο παράδειγμα.
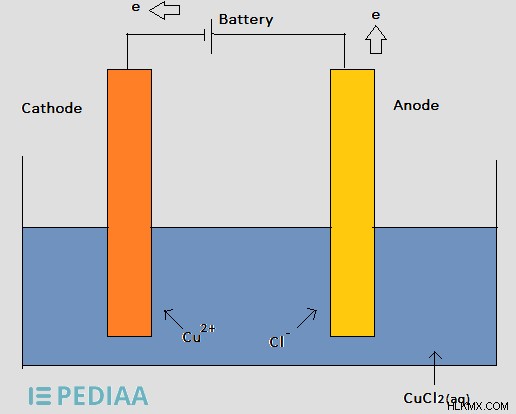
Εικόνα 2:Η ηλεκτρόλυση του διαλύματος χλωριούχου χαλκού
Στο παραπάνω ηλεκτρολυτικό στοιχείο, η μπαταρία παρέχει ηλεκτρόνια στην κάθοδο και ιόντα Cu συγκεντρώνονται γύρω από την κάθοδο για να πάρουν τα ηλεκτρόνια από την κάθοδο. Στη συνέχεια τα ιόντα Cu ανάγονται σε μέταλλο Cu και εναποτίθενται στην κάθοδο. Στη συνέχεια, τα ιόντα Cl μεταναστεύουν προς την άνοδο και απελευθερώνουν την περίσσεια ηλεκτρονίων που έχουν. Εκεί, η οξείδωση του Cl συμβαίνει σχηματίζοντας Cl2(g) .
Αντιδράσεις
- Αντίδραση στην άνοδο (οξείδωση)
2Cl(aq) → Cl2(g) + 2e
- Αντίδραση στην κάθοδο (αναγωγή)
Cu(aq) + 2e → Cu(s)
Διαφορά μεταξύ ηλεκτροχημικών κυψελών και ηλεκτρολυτικών κυψελών
Ορισμός
Ηλεκτροχημικό στοιχείο: Ένα ηλεκτροχημικό στοιχείο είναι ένα σύστημα που μπορεί να παράγει ηλεκτρική ενέργεια μέσω αυθόρμητων χημικών αντιδράσεων.
Ηλεκτρολυτικό στοιχείο: Ένα ηλεκτρολυτικό στοιχείο είναι ένας τύπος ηλεκτροχημικού στοιχείου όπου η ηλεκτρική ενέργεια μπορεί να χρησιμοποιηθεί για τη δημιουργία μιας χημικής αντίδρασης.
Μετατροπή ενέργειας
Ηλεκτροχημικό στοιχείο: Στο ηλεκτροχημικό στοιχείο, η χημική ενέργεια μετατρέπεται σε ηλεκτρική ενέργεια.
Ηλεκτρολυτικό στοιχείο: Στο ηλεκτρολυτικό στοιχείο, η ηλεκτρική ενέργεια μετατρέπεται σε χημική ενέργεια.
Εξωτερικό ρεύμα
Ηλεκτροχημικό στοιχείο: Τα ηλεκτροχημικά κύτταρα δεν χρειάζονται εξωτερικές πηγές ηλεκτρικής ενέργειας.
Ηλεκτρολυτικό στοιχείο: Τα ηλεκτρολυτικά κύτταρα χρειάζονται εξωτερικές πηγές ηλεκτρικής ενέργειας.
Χημικές αντιδράσεις
Ηλεκτροχημικό στοιχείο: Στα ηλεκτροχημικά κύτταρα λαμβάνουν χώρα αυθόρμητες χημικές αντιδράσεις.
Ηλεκτρολυτικό στοιχείο: Στα ηλεκτρολυτικά κύτταρα, λαμβάνουν χώρα μη αυθόρμητες χημικές αντιδράσεις.
Ηλεκτρόδια
Ηλεκτροχημικό στοιχείο: Σε ένα ηλεκτροχημικό στοιχείο, η άνοδος είναι αρνητική και η κάθοδος θετική.
Ηλεκτρολυτικό στοιχείο: Σε ένα ηλεκτρολυτικό στοιχείο, η άνοδος είναι θετική και η κάθοδος αρνητική.
Κίνηση ηλεκτρονίων
Ηλεκτροχημικό στοιχείο: Τα ηλεκτρόνια περνούν από την άνοδο στην κάθοδο σε ηλεκτροχημικές κυψέλες.
Ηλεκτρολυτικό στοιχείο: Τα ηλεκτρόνια περνούν από την μπαταρία στην κάθοδο και στη συνέχεια τα ηλεκτρόνια εισέρχονται στην άνοδο μέσω του ηλεκτρολυτικού διαλύματος στα ηλεκτρολυτικά κύτταρα.
Συμπέρασμα
Ένα ηλεκτρολυτικό στοιχείο είναι ένας τύπος ηλεκτροχημικού στοιχείου. Επομένως, το ηλεκτρολυτικό στοιχείο αποτελείται από όλα τα συστατικά που έχει ένα τυπικό ηλεκτροχημικό στοιχείο. Τόσο τα ηλεκτροχημικά κύτταρα όσο και τα ηλεκτρολυτικά στοιχεία περιλαμβάνουν την κυκλοφορία ηλεκτρονίων μέσω του συστήματος. Ωστόσο, στα ηλεκτροχημικά κύτταρα, λαμβάνουν χώρα αυθόρμητες χημικές αντιδράσεις, ενώ οι μη αυθόρμητες χημικές αντιδράσεις λαμβάνουν χώρα σε ηλεκτρολυτικά κύτταρα. Αυτή είναι η διαφορά μεταξύ του ηλεκτροχημικού στοιχείου και του ηλεκτρολυτικού στοιχείου.