Συντεταγμένος ομοιοπολικός δεσμός – δοτικός δεσμός
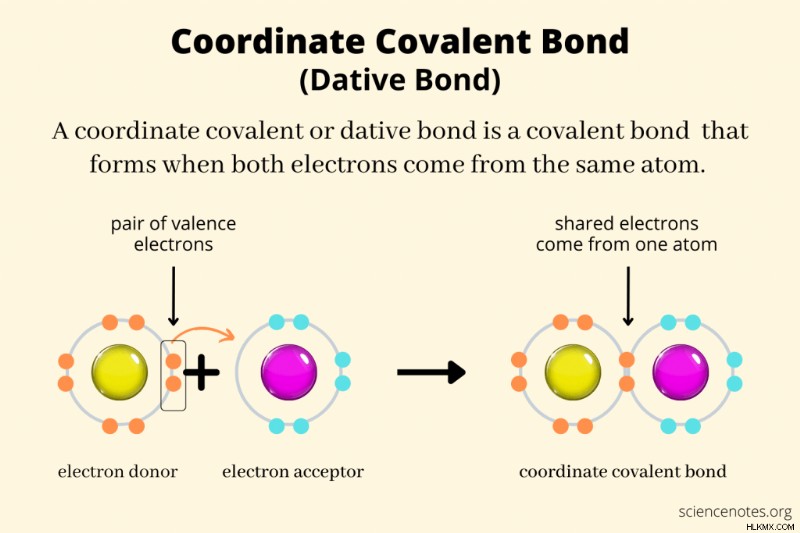
Στη χημεία, ένας συντεταγμένος ομοιοπολικός δεσμός , δοτικός δεσμός , ή δεσμός συντεταγμένων είναι ένας τύπος ομοιοπολικού δεσμού που σχηματίζεται όταν και τα δύο κοινά ηλεκτρόνια δεσμών προέρχονται από ένα μόνο από τα άτομα. Ο γενικότερος όρος "ομοιοπολικός δεσμός" καλύπτει περιπτώσεις όπου κάθε άτομο συνεισφέρει ένα ηλεκτρόνιο δεσμού ή όταν ένα άτομο συνεισφέρει και τα δύο ηλεκτρόνια. Σε έναν ομοιοπολικό δεσμό συντεταγμένων, η έλξη και των δύο πυρήνων στο ζεύγος ηλεκτρονίων συγκρατεί τον δεσμό μαζί. Συντεταγμένοι ομοιοπολικοί δεσμοί σχηματίζονται σε αντιδράσεις οξέος και βάσης Lewis, δεσμοί μεταλλικών ιόντων με συνδέτες και μερικές φορές μεταξύ μη μετάλλων.
Η IUPAC θεωρεί τον όρο «δοτικό δεσμό» ως ξεπερασμένο και προτιμά τον «συντεταγμένο δεσμό» έναντι του «συντεταγμένου ομοιοπολικό δεσμό». Στα διαγράμματα, οι ομοιοπολικοί δεσμοί συντεταγμένων υποδεικνύονται χρησιμοποιώντας ένα βέλος αντί για απλή συνεχή γραμμή.
Παραδείγματα ομοιοπολικών δεσμών συντεταγμένων
Ένα κλασικό παράδειγμα ομοιοπολικού δεσμού συντεταγμένων σχηματίζεται όταν αέρια αμμωνία (NH3 ) και το υδροχλώριο (HCl) αντιδρούν και σχηματίζουν ιόντα αμμωνίου (NH4 ) και ιόντα χλωρίου και τελικά χλωριούχο αμμώνιο (NH4 Cl). Αυτή είναι η επίδειξη χημείας "λευκού καπνού".
NH3 (ζ) + HCl(g) → NH4 Cl(s)
Το μόριο υδροχλωρίου μεταφέρει ένα άτομο υδρογόνου (πρωτόνιο) στο μοναχικό ζεύγος του μορίου αμμωνίας, σχηματίζοντας το ιόν αμμωνίου. Στο ιόν αμμωνίου, ένας ομοιοπολικός δεσμός συντεταγμένων συνδέει το τέταρτο υδρογόνο με το μόριο. Μόλις σχηματιστεί ο χημικός δεσμός, δεν υπάρχει τρόπος να ξεχωρίσουμε τους συνηθισμένους ομοιοπολικούς και συντεταγμένους ομοιοπολικούς δεσμούς. Εν τω μεταξύ, η απομάκρυνση του υδρογόνου από το υδροχλώριο αφήνει ένα ανιόν χλωρίου.
Ένα άλλο παράδειγμα ενός ομοιοπολικού δεσμού συντεταγμένων σχηματίζεται στην αντίδραση μεταξύ αμμωνίας και τριφθοριούχου βορίου (BF3 ) που σχηματίζει τριφθοριούχο βόριο αμμωνίας (NH3 BF3 ). Το τριφθοριούχο βόριο είναι μια ενδιαφέρουσα ένωση επειδή δεν έχει δομή ευγενούς αερίου γύρω από το άτομο του βορίου. Το βόριο έχει μόνο τρία ζεύγη ηλεκτρονίων σύνδεσης, παρόλο που υπάρχει χώρος για τέσσερα ζεύγη. Έτσι, αν και BF3 είναι σταθερό, έχει έλλειψη ηλεκτρονίων. Το μοναχικό ζεύγος από άζωτο σχηματίζει έναν δοτικό δεσμό με το βηρύλλιο, δίνοντάς του την οκτάδα.
Ως άλλο παράδειγμα, εξετάστε το μονοξείδιο του άνθρακα (CO). Αυτό το μόριο περιέχει δύο ομοιοπολικούς δεσμούς που σχηματίζονται με ισομερή κοινή χρήση ηλεκτρονίων από άνθρακα και οξυγόνο και έναν δεσμό συντεταγμένων χρησιμοποιώντας ένα μοναχικό ζεύγος που παρέχεται από το άτομο οξυγόνου.
Αντίθετα, το διοξείδιο του άνθρακα (CO2 ) δεν έχουν δοτικό δεσμό. Σε κάθε μόριο διοξειδίου του άνθρακα υπάρχουν τέσσερις δεσμοί άνθρακα-οξυγόνου. Κάθε δεσμός περιέχει ένα ηλεκτρόνιο από κάθε άτομο. Οι δεσμοί είναι ομοιοπολικοί, αλλά όχι συντεταγμένοι.
Άλλα παραδείγματα ενώσεων που περιέχουν δεσμούς συντεταγμένων ή δοτικών περιλαμβάνουν:
- Ιόν υδρονίου (H3 Ο) :Το οξυγόνο είναι ο δότης ενός ζεύγους ηλεκτρονίων ενώ το υδρογόνο είναι ο δέκτης.
- Χλωριούχο αργίλιο (Al2 Cl6 ) :Κάθε άτομο αλουμινίου χρειάζεται δύο ηλεκτρόνια για να ολοκληρώσει το κέλυφος σθένους του. Ένα άτομο χλωρίου έχει ένα μακρύ ζεύγος. Ένα άτομο Al σχηματίζει έναν δεσμό συντεταγμένων με το άτομο Cl στο γειτονικό AlCl3 ομάδα. Έτσι, το χλωριούχο αλουμίνιο είναι ουσιαστικά ένα ομοιοπολικό διμερές μόριο και όχι μια ιοντική ένωση.
Συντεταγμένος δεσμός εναντίον ομοιοπολικού δεσμού
Υπάρχουν διαφορές μεταξύ ενός δεσμού συντεταγμένων και ενός ομοιοπολικού δεσμού που σχηματίζεται όταν κάθε άτομο συνεισφέρει ένα ηλεκτρόνιο.
- Ένας δεσμός συντεταγμένων είναι πιο πολικός.
- Ο δεσμός συντεταγμένων είναι άκαμπτος και κατευθυντικός.
- Οι δεσμοί συντεταγμένων είναι μακρύτεροι από τους κανονικούς ομοιοπολικούς δεσμούς.
- Οι δεσμοί συντεταγμένων είναι πιο αδύναμοι από τους κανονικούς ομοιοπολικούς δεσμούς.
- Ο συντονισμός δεν περιλαμβάνει απαραίτητα δεσμό δύο ηλεκτρονίων μεταξύ δύο ατόμων.
- Ένας καθαρός ομοιοπολικός δεσμός μπορεί να προκύψει μεταξύ δύο ατόμων του ίδιου στοιχείου (π.χ., H2 ). Ένας δεσμός συντεταγμένων περιλαμβάνει πάντα δύο ανόμοια άτομα.
- Οι συντεταγμένες ενώσεις τείνουν να είναι ελάχιστα διαλυτές στο νερό.
Αναφορές
- IUPAC (1997) «Διπολικός δεσμός». Σύνοψη Χημικής Ορολογίας (το «Χρυσό Βιβλίο») (2η έκδ.). Oxford:Blackwell Scientific Publications. doi:10.1351/goldbook.D01752
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2η έκδ.). Butterworth-Heinemann. ISBN:978-0-08-037941-8.
- Haaland, Arne (1989). «Ομοιοπολικοί δεσμοί έναντι των δεσμών σε μέταλλα κύριας ομάδας, μια χρήσιμη διάκριση». Angewandte Chemie International Edition στα Αγγλικά . 28 (8):992–1007. doi:10.1002/anie.198909921
- Himmel, Daniel; Krossing, Ingo; Schnepf, Andreas (2014). "Οι δεσμοί σε συνθέσεις κύριας ομάδας:περίπτωση για λιγότερα βέλη!". Angewandte Chemie International Edition . 53 (2):370–374. doi:10.1002/anie.201300461
- Khare, E.; Holten-Andersen, Ν.; Buehler, M.J. (2021). «Δεσμοί συντεταγμένων μετάλλου μετάπτωσης για βιοεμπνευσμένα μακρομόρια με συντονίσιμες μηχανικές ιδιότητες». Nat Rev Mater . 6:421–436. doi:10.1038/s41578-020-00270-z




