Διαφορά μεταξύ λανθανοειδών και ακτινοειδών
Κύρια διαφορά – Λανθανοειδή εναντίον Ακτινοειδών
Τα λανθανοειδή και τα ακτινοειδή είναι χημικά στοιχεία που υπάρχουν στις σειρές λανθανιδών και ακτινιδών του περιοδικού πίνακα αντίστοιχα. Αυτά τα στοιχεία είναι γνωστά ως στοιχεία μπλοκ f. Αυτό συμβαίνει επειδή τα ηλεκτρόνια σθένους τους βρίσκονται στο τροχιακό f των ατόμων τους. Όλα τα λανθανοειδή και τα ακτινοειδή είναι μέταλλα. Ονομάζονται επίσης μέταλλα εσωτερικής μετάπτωσης. Αυτό συμβαίνει επειδή τα εξωτερικά τροχιακά τους f καλύπτονται από άλλα τροχιακά. Αυτά τα στοιχεία ονομάζονται ως έχουν, καθώς η σειρά ακτινιδών ξεκινά από μια χημική ουσία που ονομάζεται ακτίνιο και η σειρά λανθανιδών ξεκινά από ένα χημικό στοιχείο που ονομάζεται Λανθάνιο. Η κύρια διαφορά μεταξύ των ακτινιδών και των λανθανιδών είναι ότι οι ακτινίδες μπορούν να σχηματίσουν σύμπλοκα εύκολα ενώ οι λανθανίδες δεν σχηματίζουν σύμπλοκα εύκολα.
Βασικές περιοχές που καλύπτονται
1. Τι είναι τα λανθανοειδή
– Ορισμός, χημικές αντιδράσεις και ιδιότητες
2. Τι είναι τα Ακτινοειδή
– Ορισμός, Χημικές ιδιότητες
3. Ποια είναι η διαφορά μεταξύ των λανθανοειδών και των ακτινοειδών
– Σύγκριση βασικών διαφορών
Βασικοί όροι:ακτινοειδή, ακτίνιο, στοιχεία μπλοκ F, μέταλλα εσωτερικής μετάβασης, λανθανίδες, λανθανοειδή, λανθάνιο

Τι είναι τα Lanthanoids
Τα λανθανοειδή είναι χημικά στοιχεία που μπορούν να βρεθούν στη σειρά λανθανιδών του μπλοκ f στον περιοδικό πίνακα στοιχείων. Τα λανθανοειδή είναι μη ραδιενεργά εκτός από το προμέθιο. Δεδομένου ότι οι ατομικοί αριθμοί των λανθανοειδών κυμαίνονται από 57 έως 71, αποτελούνται επίσης από σχετικά μεγάλα άτομα. Τα ηλεκτρόνια σθένους των λανθανοειδών βρίσκονται στο τροχιακό 4f. Λέγονται και Λανθανίδες .
Τα λανθανοειδή είναι μέταλλα και έχουν λαμπερή και ασημί εμφάνιση. Είναι πολύ μαλακά και μπορούν να κοπούν ακόμη και με ένα μαχαίρι. Τα στοιχεία λανθάνιο, δημήτριο, πρασεοδύμιο, νεοδύμιο και ευρώπιο της σειράς λανθανιδών είναι εξαιρετικά αντιδραστικά σε σύγκριση με άλλα μέλη. Όταν αυτά τα μέταλλα εκτίθενται στον αέρα, σχηματίζουν επικαλύψεις οξειδίων. Αμαυρώνονται για αυτόν τον λόγο.
Τα λανθανοειδή αντιδρούν γρήγορα με ζεστό νερό αλλά αργά με κρύο νερό. Όταν αυτά τα μέταλλα είναι μολυσμένα με άλλα μέταλλα όπως το ασβέστιο, διαβρώνονται γρήγορα. Αλλά όταν τα λανθανοειδή μολύνονται με αμέταλλα όπως το άζωτο και το οξυγόνο, γίνονται εύθραυστα. Αυτές οι μολύνσεις μεταβάλλουν το σημείο βρασμού των λανθανοειδών.
Τα λανθανοειδή διαλύονται γρήγορα στα οξέα. Μπορούν να αντιδράσουν με το οξυγόνο και τα αλογονίδια, αλλά αργά. Η πιο εμφανής κατάσταση οξείδωσης των λανθανοειδών είναι +3. Άλλες καταστάσεις οξείδωσης που εμφανίζουν τα λανθανοειδή είναι +2 και +4. Αλλά δεν μπορούν να έχουν κατάσταση οξείδωσης +6. Επομένως, δεν μπορούν να σχηματίσουν πολύπλοκα μόρια. Τα λανθανοειδή δεν σχηματίζουν οξοκώσεις όπως οξείδια και υδροξείδια. Τα μόρια που σχηματίζονται από τα λανθανοειδή είναι λιγότερο βασικά.
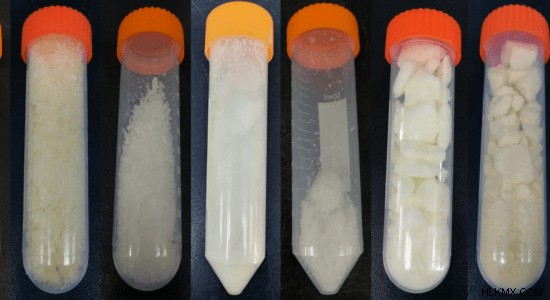
Εικόνα 1:Νιτρικά άλατα λανθανίδης
Σχεδόν όλα τα ιόντα που σχηματίζονται από τα λανθανοειδή είναι άχρωμα. Τα λανθανοειδή είναι ηλεκτροθετικά στοιχεία. Ως εκ τούτου, προτιμούν να σχηματίζουν μόρια με ηλεκτραρνητικά στοιχεία. Ωστόσο, οι αλλαγές στις χημικές και φυσικές ιδιότητες είναι πολύ λιγότερες σε όλη τη σειρά.
Τι είναι τα Actinoids
Τα ακτινοειδή είναι χημικά στοιχεία που μπορούν να βρεθούν στη σειρά ακτινιδών του μπλοκ f στον περιοδικό πίνακα στοιχείων. Όλα τα ακτινοειδή είναι ραδιενεργά στοιχεία λόγω της ασταθούς φύσης τους. Δεν έχουν σταθερά ισότοπα. Αυτά τα στοιχεία αποτελούνται από πολύ μεγάλα άτομα. Τα ακτινοειδή έχουν τα ηλεκτρόνια σθένους τους στο τροχιακό 5f. Η σειρά ακτινιδών αποτελείται από χημικά στοιχεία με ατομικούς αριθμούς 89 έως 103.
Τα ακτινοειδή είναι εξαιρετικά ηλεκτροθετικά. Αυτό σημαίνει ότι έχουν πολύ μικρή ή καθόλου συγγένεια ηλεκτρονίων. Δεδομένου ότι πρόκειται για στοιχεία υψηλής αντίδρασης, αναφλέγονται εύκολα στον αέρα. Αν και είναι μέταλλα, τα ακτινοειδή είναι πολύ μαλακά. Μερικά από αυτά μπορούν να κοπούν ακόμη και με ένα μαχαίρι. Όλα τα ακτινοειδή είναι παραμαγνητικά (μπορούν να έλκονται από ένα εξωτερικό μαγνητικό πεδίο).
Εικόνα 2:Ακτινίδες
Τα πιο κοινά και άφθονα ακτινοειδή στη γη είναι το Ουράνιο και το Θόριο. Είναι ασθενώς ραδιενεργά και απελευθερώνουν υψηλή ενέργεια κατά τη διάρκεια της ραδιενεργής αποσύνθεσης. Η έντονη κατάσταση οξείδωσης μεταξύ των Actinoids είναι +3. Επιπλέον, τα ακτινοειδή εμφανίζουν καταστάσεις οξείδωσης όπως +4, +5 και +6.
Τα ακτινοειδή σχηματίζουν βασικά οξείδια και υδροξείδια. Έχουν την ικανότητα να σχηματίζουν σύμπλοκα με συνδέτες όπως χλωρίδια, θειικά κ.λπ. Τα περισσότερα σύμπλοκα Ακτινοειδών είναι πολύχρωμα. Ωστόσο, λόγω της ραδιενέργειας και της συμπεριφοράς των βαρέων μετάλλων, τα ακτινοειδή θεωρούνται τοξικές ενώσεις.
Διαφορά μεταξύ λανθανοειδών και ακτινοειδών
Ορισμός
Λανθανοειδή: Τα λανθανοειδή είναι χημικά στοιχεία που μπορούν να βρεθούν στη σειρά λανθανιδών του μπλοκ f στον περιοδικό πίνακα στοιχείων.
Ακτινοειδή: Τα ακτινοειδή είναι χημικά στοιχεία που μπορούν να βρεθούν στη σειρά ακτινιδών του μπλοκ f στον περιοδικό πίνακα στοιχείων.
Σειρά στον περιοδικό πίνακα
Λανθανοειδή: Τα λανθανοειδή ανήκουν στη σειρά λανθανιδών.
Ακτινοειδή: Τα ακτινοειδή ανήκουν στη σειρά ακτινιδών.
Ραδιενέργεια
Λανθανοειδή: Τα λανθανοειδή είναι μη ραδιενεργά στοιχεία (εκτός από το προμέθιο).
Ακτινοειδή: Τα ακτινοειδή είναι ραδιενεργά στοιχεία.
Ηλεκτρόνια σθένους
Λανθανοειδή: Τα λανθανοειδή έχουν τα ηλεκτρόνια σθένους τους σε τροχιακό 4f.
Ακτινοειδή: Τα ακτινοειδή έχουν τα ηλεκτρόνια σθένους τους σε τροχιακό 5f.
Καταστάσεις οξείδωσης
Λανθανοειδή: Τα λανθανοειδή μπορούν να έχουν το πολύ +4 κατάσταση οξείδωσης.
Ακτινοειδή: Τα ακτινοειδή μπορούν να έχουν το πολύ +6 κατάσταση οξείδωσης.
Ατομικοί αριθμοί
Λανθανοειδή: Τα λανθανοειδή περιλαμβάνουν στοιχεία με ατομικούς αριθμούς που κυμαίνονται από 57 έως 71.
Ακτινοειδή: Τα ακτινοειδή περιλαμβάνουν στοιχεία με ατομικούς αριθμούς που κυμαίνονται από 89 έως 103.
Συμπέρασμα
Τα λανθανοειδή και τα ακτινοειδή είναι στοιχεία μπλοκ του περιοδικού πίνακα. Είναι μέταλλα αλλά είναι πολύ μαλακά. Έχουν διαφορετικές χημικές ιδιότητες. Η κύρια διαφορά μεταξύ των ακτινιδών και των λανθανιδών είναι ότι οι ακτινίδες μπορούν να σχηματίσουν σύμπλοκα εύκολα, ενώ οι λανθανίδες δεν σχηματίζουν σύμπλοκα εύκολα.
Αναφορά:
1. Helmenstine, Anne Marie. "Λάβετε τα γεγονότα σχετικά με την ομάδα στοιχείων Actinides". ThoughtCo, Διαθέσιμο εδώ.
2. "Lanthanides." Science of Everyday Things, Encyclopedia.com, Διαθέσιμο εδώ.
Εικόνα Ευγενική προσφορά:
1. «Νιτρικά άλατα λανθανίδης» του Leiem – Δική του εργασία (CC BY-SA 4.0) μέσω Commons Wikimedia
2. «Actinide-table» (CC BY-SA 3.0) μέσω Commons Wikimedia




