Τάση και ορισμός συγγένειας ηλεκτρονίων
Συγγένεια ηλεκτρονίων (Ε ea ) είναι η μεταβολή της ενέργειας όταν προστίθεται ένα ηλεκτρόνιο σε ένα ουδέτερο άτομο στην αέρια φάση. Με απλά λόγια, είναι ένα μέτρο της ικανότητας ενός ουδέτερου ατόμου να αποκτήσει ένα ηλεκτρόνιο. Το άτομο αέριας φάσης χρησιμοποιείται (και όχι υγρό ή στερεό) επειδή τα επίπεδα ενέργειας του ατόμου δεν επηρεάζονται από γειτονικά άτομα. Οι πιο κοινές μονάδες για τη συγγένεια ηλεκτρονίων είναι kilojoules ανά mol (kJ/mol) ή ηλεκτρονβολτ (eV). Η συγγένεια ηλεκτρονίων ισχύει επίσης για μόρια, σε ορισμένες περιπτώσεις.
- Συγγένεια ηλεκτρονίων είναι η μεταβολή της ενέργειας όταν ένα άτομο αποκτά ένα ηλεκτρόνιο.
- Για τα περισσότερα στοιχεία, εκτός από τα ευγενή αέρια, αυτή είναι μια εξώθερμη διαδικασία.
- Η συγγένεια ηλεκτρονίων αυξάνεται κατά τη διάρκεια μιας περιόδου και μερικές φορές μειώνεται κινούμενος προς τα κάτω σε μια ομάδα.
- Ο λόγος που η συγγένεια των ηλεκτρονίων αυξάνεται κατά τη διάρκεια μιας περιόδου είναι επειδή αυξάνεται το ενεργό πυρηνικό φορτίο, το οποίο προσελκύει ηλεκτρόνια.
Ιστορικό
Το 1934, ο Robert S. Mulliken εφάρμοσε συγγένειες ηλεκτρονίων για να απαριθμήσει μια κλίμακα ηλεκτραρνητικότητας για τα άτομα του περιοδικού πίνακα. Το ηλεκτρονικό χημικό δυναμικό και η χημική σκληρότητα χρησιμοποιούν επίσης την αρχή της συγγένειας ηλεκτρονίων. Ένα άτομο με πιο θετική τιμή συγγένειας ηλεκτρονίων από ένα άλλο άτομο είναι δέκτης ηλεκτρονίων, ενώ ένα με μικρότερη θετική τιμή είναι δότης ηλεκτρονίων.
Πώς λειτουργεί η συγγένεια ηλεκτρονίων (Σύμβαση σημείων)
Τα άτομα αποκτούν ή χάνουν ενέργεια όταν αποκτούν ή χάνουν ηλεκτρόνια ή συμμετέχουν σε χημικές αντιδράσεις. Το πρόσημο της αλλαγής ενέργειας εξαρτάται από το αν συνδέετε ή αφαιρείτε ένα ηλεκτρόνιο. Να είστε προσεκτικοί, γιατί το σημάδι για την αλλαγή της ενέργειας (ΔΕ ) είναι το αντίθετο του πρόσημου για τη συγγένεια ηλεκτρονίων (E ea )!
Ε ea =ΔΕ (επισύναψη)
Για σύνδεση ηλεκτρονίου:
- Όταν τα άτομα απελευθερώνουν ενέργεια, η αντίδραση είναι εξώθερμη. Η μεταβολή της ενέργειας ΔE έχει αρνητικό πρόσημο και τη συγγένεια ηλεκτρονίων E ea έχει θετικό πρόσημο.
- Όταν τα άτομα απορροφούν ενέργεια, η αντίδραση είναι ενδόθερμη. Η μεταβολή της ενέργειας ΔE έχει θετικό πρόσημο και τη συγγένεια ηλεκτρονίων E ea έχει αρνητικό πρόσημο.
Η συγγένεια ηλεκτρονίων για τα περισσότερα άτομα στον περιοδικό πίνακα, εκτός από τα ευγενή αέρια, είναι εξώθερμη. Βασικά, απαιτείται ενέργεια για να συνδεθεί ένα ηλεκτρόνιο. Έτσι, για τα περισσότερα άτομα, ΔE είναι αρνητικό και E ea είναι θετικό. Για τα ευγενή αέρια ΔΕ είναι θετικό και Ε ea είναι αρνητικό. Ένα άτομο ευγενούς αερίου είναι ήδη σταθερό, επομένως απορροφά ενέργεια για να συλλάβει ένα άλλο ηλεκτρόνιο. Για τα ευγενή αέρια, η σύλληψη ηλεκτρονίων είναι ενδόθερμη.
Ωστόσο , ορισμένοι πίνακες παραθέτουν τιμές για την κατάργηση ενός ηλεκτρονίου από ένα ουδέτερο άτομο αντί της σύλληψης ενός ηλεκτρονίου. Η ενεργειακή τιμή είναι ισοδύναμη, αλλά το πρόσημο αντιστρέφεται.
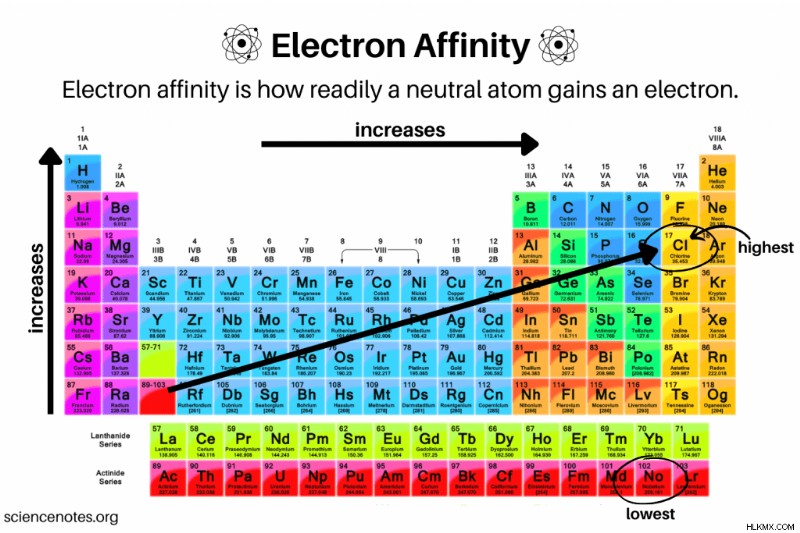
Τάση συγγένειας ηλεκτρονίων στον περιοδικό πίνακα
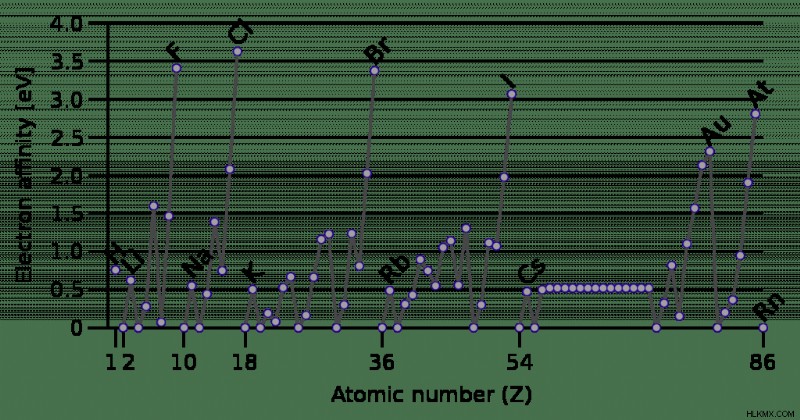
Όπως η ηλεκτραρνητικότητα, η ενέργεια ιονισμού, η ατομική ή ιοντική ακτίνα και ο μεταλλικός χαρακτήρας, η ηλεκτραρνητικότητα εμφανίζει τάσεις περιοδικού πίνακα. Σε αντίθεση με ορισμένες από αυτές τις άλλες ιδιότητες, υπάρχουν πολλές εξαιρέσεις στις τάσεις για συγγένεια ηλεκτρονίων.
- Η γενική συνάφεια ηλεκτρονίων αυξάνεται που κινείται σε μια γραμμή ή περίοδο του περιοδικού πίνακα , μέχρι να φτάσετε στην ομάδα 18 ή στα ευγενή αέρια. Αυτό οφείλεται στο γέμισμα του κελύφους ηλεκτρονίων σθένους που κινείται σε μια περίοδο. Για παράδειγμα, ένα άτομο της ομάδας 17 (αλογόνο) γίνεται πιο σταθερό κερδίζοντας ένα ηλεκτρόνιο, ενώ μια ομάδα 1 (αλκαλιμέταλλο) πρέπει να προσθέσει πολλά ηλεκτρόνια για να φτάσει σε ένα σταθερό κέλυφος σθένους. Επιπλέον, το ενεργό πυρηνικό φορτίο αυξάνεται καθώς κινείστε σε μια περίοδο.
- Τα ευγενή αέρια έχουν χαμηλή συγγένεια ηλεκτρονίων.
- Γενικά (με εξαιρέσεις) τα αμέταλλα έχουν υψηλότερο ή πιο θετικό Eea αξία από τα μέταλλα.
- Τα άτομα που σχηματίζουν ανιόντα που είναι πιο σταθερά από τα ουδέτερα άτομα έχουν υψηλές τιμές συγγένειας ηλεκτρονίων.
- Αν και συνήθως απεικονίζεται σε ένα διάγραμμα τάσεων του περιοδικού πίνακα, η συγγένεια ηλεκτρονίων δεν αξιόπιστη μείωση που κινείται προς τα κάτω σε στήλη ή ομάδα. Στην ομάδα 2 (μέταλλα αλκαλικών γαιών), Eea στην πραγματικότητα αυξάνεται καθώς μετακινείστε προς τα κάτω στον περιοδικό πίνακα.
Διαφορά μεταξύ συγγένειας ηλεκτρονίων και ηλεκτροαρνητικότητας
Η συγγένεια ηλεκτρονίων και η ηλεκτραρνητικότητα είναι σχετικές έννοιες, αλλά δεν σημαίνουν το ίδιο πράγμα. Κατά κάποιο τρόπο, και τα δύο είναι ένα μέτρο της ικανότητας ενός ατόμου να προσελκύει ένα ηλεκτρόνιο. Όμως, η συγγένεια ηλεκτρονίων είναι η αλλαγή ενέργειας ενός αέριου ουδέτερου ατόμου κατά την αποδοχή ενός ηλεκτρονίου, ενώ η ηλεκτραρνητικότητα είναι ένα μέτρο του πόσο εύκολα ένα άτομο έλκει ένα δεσμευτικό ζεύγος ηλεκτρονίων που μπορεί να σχηματίσει έναν χημικό δεσμό. Οι δύο τιμές έχουν διαφορετικές μονάδες και κάπως διαφορετικές τάσεις του περιοδικού πίνακα.
| Ηλεκτραρνητικότητα | Συγγένεια ηλεκτρονίων | |
|---|---|---|
| Ορισμός | Ικανότητα του ατόμου να προσελκύει ηλεκτρόνια | Ποσότητα ενέργειας που απελευθερώνεται ή απορροφάται όταν ουδέτερο άτομο ή μόριο δέχεται ηλεκτρόνιο |
| Εφαρμογή | Μόνο μεμονωμένο άτομο | Συνήθως, μεμονωμένο άτομο, αλλά η έννοια ισχύει και για ένα μόριο |
| Μονάδες | Παύση μονάδων | kJ/mol ή eV |
| Ιδιότητα | Ποιοτικό | Ποσοτικά |
| Τάσεις του περιοδικού πίνακα | Αυξάνει τη μετακίνηση από αριστερά προς τα δεξιά σε μια περίοδο (εκτός από ευγενή αέρια) Μειώνει τη μετακίνηση προς τα κάτω σε μια ομάδα | Αυξάνει τη μετακίνηση από αριστερά προς τα δεξιά κατά τη διάρκεια μιας περιόδου (εκτός από τα ευγενή αέρια) |
Ποιο στοιχείο έχει την υψηλότερη συγγένεια ηλεκτρονίων;
Τα αλογόνα, γενικά, δέχονται εύκολα ηλεκτρόνια και έχουν υψηλές συγγένειες ηλεκτρονίων. Το στοιχείο με τη μεγαλύτερη συγγένεια ηλεκτρονίων είναι το χλώριο, με τιμή 349 kJ/mole. Το χλώριο αποκτά μια σταθερή οκτάδα όταν συλλαμβάνει ένα ηλεκτρόνιο.
Ο λόγος για τον οποίο το χλώριο έχει μεγαλύτερη συγγένεια ηλεκτρονίων από το φθόριο είναι επειδή το άτομο φθορίου είναι μικρότερο. Το χλώριο έχει ένα πρόσθετο κέλυφος ηλεκτρονίων, επομένως το άτομό του φιλοξενεί πιο εύκολα το ηλεκτρόνιο. Με άλλα λόγια, υπάρχει λιγότερη απώθηση ηλεκτρονίου-ηλεκτρονίου στο κέλυφος ηλεκτρονίων χλωρίου.
Ποιο στοιχείο έχει τη χαμηλότερη συγγένεια ηλεκτρονίων;
Τα περισσότερα μέταλλα έχουν χαμηλότερες τιμές συγγένειας ηλεκτρονίων. Το Nobelium είναι το στοιχείο με τη χαμηλότερη συγγένεια ηλεκτρονίων (-223 kJ/mol). Τα άτομα του Nobelium χάνουν εύκολα ηλεκτρόνια, αλλά το να εξαναγκάσουν ένα άλλο ηλεκτρόνιο σε ένα άτομο που είναι ήδη τεράστιο δεν είναι θερμοδυναμικά ευνοϊκό. Όλα τα υπάρχοντα ηλεκτρόνια λειτουργούν ως οθόνη ενάντια στο θετικό φορτίο του ατομικού πυρήνα.
Συγγένεια πρώτου ηλεκτρονίου έναντι συνάφειας δεύτερου ηλεκτρονίου
Συνήθως, οι πίνακες αναφέρουν την πρώτη συγγένεια ηλεκτρονίων. Αυτή είναι η ενεργειακή αλλαγή με την προσθήκη του πρώτου ηλεκτρονίου σε ένα ουδέτερο άτομο. Για τα περισσότερα στοιχεία, αυτή είναι μια εξώθερμη διαδικασία. Από την άλλη πλευρά, η μεταβολή της ενέργειας με την προσθήκη ενός δεύτερου ηλεκτρονίου είναι η δεύτερη τιμή συγγένειας ηλεκτρονίων. Συνήθως, αυτό απαιτεί περισσότερη ενέργεια από ό,τι κερδίζει το άτομο. Οι περισσότερες τιμές συγγένειας δεύτερων ηλεκτρονίων αντικατοπτρίζουν ενδόθερμες διεργασίες.
Έτσι, εάν η πρώτη τιμή συγγένειας ηλεκτρονίων είναι θετική, τότε η δεύτερη τιμή συγγένειας ηλεκτρονίων είναι συνήθως αρνητική. Εάν χρησιμοποιείτε τη σύμβαση του άλλου πρόσημου, εάν η πρώτη συγγένεια ηλεκτρονίων είναι αρνητική, τότε η συγγένεια του δεύτερου ηλεκτρονίου είναι θετική.
Αναφορές
- Anslyn, Eric V.; Dougherty, Dennis A. (2006). Σύγχρονη Φυσική Οργανική Χημεία . Πανεπιστημιακά επιστημονικά βιβλία. ISBN 978-1-891389-31-3.
- IUPAC (1997). «Συγγένεια ηλεκτρονίων». Compendium of Chemical Terminology (the “Gold Book”) (2η έκδ.). Oxford:Blackwell Scientific Publications. doi:10.1351/goldbook.E01977
- Mulliken, Robert S. (1934). «Μια νέα κλίμακα ηλεκτροσυγγένειας. Μαζί με δεδομένα για τις καταστάσεις σθένους και για τα δυναμικά ιονισμού σθένους και τις συγγένειες ηλεκτρονίων." J. Chem. Phys . 2:782. doi:10.1063/1.1749394
- Tro, Nivaldo J. (2008). Χημεία:Μοριακή Προσέγγιση (2η Έκδοση). New Jersey:Pearson Prentice Hall. ISBN 0-13-100065-9.