Φθαλιμίδιο – Παρασκευή, Χημικές Αντιδράσεις &Χρήσεις με Παράδειγμα
Τα φθαλιμίδια είναι το φυσικό αρωματικό μόριο με τον χημικό τύπο C6 H4 (CO)2 ΝΗ, που αποτελείται από ετεροάτομο αζώτου. Διαθέτει ομοιοπολικό δεσμό σταθεροποιημένο σε συντονισμό και όξινο pH. Ο συντονισμός αυξάνει την αντίσταση της δομής. Μια ισχυρή βάση μπορεί εύκολα να αφαιρέσει το άτομο Η που συνδέεται με το πυρηνόφιλο. Το προκύπτον ιόν μπορεί στη συνέχεια να αντιδράσει με βρώμιο για να δημιουργήσει Ν-βρωμοφθαλιμίδιο. Η σύνθεση του Gabriel Phthalimide είναι ένα κρίσιμο στάδιο σε αυτή τη διαδικασία, καθώς παράγει αλειφατικές αμίνες. Το άρθρο εξετάζει τα φθαλιμίδια, τις χημικές αντιδράσεις, τις χρήσεις και τις φυσικές και χημικές τους ιδιότητες.
Τι είναι το Phthalimide;
Το φθαλιμίδιο παράγεται από τη χρήση φθαλικού ανυδρίτη. Η ουσία που σχηματίζεται είναι το αμιδικό παράγωγο του φθαλικού ανυδρίτη, το ιμίδιο του φθαλικού ανυδρίτη. Η υδατοδιαλυτότητα μπορεί να εξατμίσει αυτό το στερεό λευκό ίζημα. Και περισσότερο μετά την προσθήκη της βάσης. Χρησιμεύει ως πρόδρομος σε άλλα οργανικά μόρια και ως υπόγεια πηγή αμμωνίας. Ανήκει σε μια οικογένεια ενώσεων αζώτου. Το φθαλιμίδιο παράγεται από φθαλικό ανυδρίτη.
Ενδιαφέροντα γεγονόταΧημικά, το φθαλιμίδιο του καλίου έχει τον τύπο C8 H4 KNO2 . Το φθαλιμιδικό άλας καλίου εμφανίζεται συχνά ως αφράτοι, εξαιρετικά ωχροκίτρινοι κρύσταλλοι. Το επιθυμητό προϊόν καθιζάνει όταν ένα θερμαινόμενο διάλυμα φθαλιμιδίου σε αιθανόλη προστίθεται σε ένα μίγμα υδροξειδίου του καλίου σε αιθανόλη. Το φθαλιμίδιο του καλίου είναι ένα αντιδραστήριο που μπορεί να αγοραστεί για τη σύνθεση αμινών Gabriel. |
Πληροφοριακές λεπτομέρειεςΔεδομένου ότι τα φθαλιμίδια διαθέτουν αναλγητικά, αντιφλεγμονώδη και αντισπασμωδικά χαρακτηριστικά, χρησιμοποιούνται εκτενώς στην παρασκευή φαρμακευτικών προϊόντων και χημικών ενώσεων. Χρησιμοποιείται ευρέως στις βιομηχανίες βαφής. Χρησιμεύει ως κρυφή πηγή αμμωνίας. Ως εκ τούτου, είναι χρήσιμο στην παραγωγή μορίων που περιέχουν άζωτο. |
Σύνθεση φθαλιμιδίου
Ο χημικός τύπος του φθαλιμιδίου είναι C6 H4 (CO)2 NH. Αυτή η χημική ένωση περιλαμβάνει δακτυλίους βενζολίου, ένα άτομο υδρογόνου, δύο ενώσεις καρβονυλίου και ένα πυρηνόφιλο. (Ένα ετεροάτομο αζώτου υπάρχει σε έναν άλλο πενταμελή κύκλο.) Η αυξημένη σταθερότητα της ένωσης οφείλεται σε δομές συντονισμού. Ο παρακάτω πίνακας παρέχει μια ανάλυση της χημικής σύνθεσης της φθαλιμίδης:
| Σύνθεση | Πληροφορίες |
| Δομική Σύνθεση | C 58,53%, H 4,91%, N 17,06%, O 19,49% |
| Χημικά ασφαλές | Διαβρωτική, Ερεθιστική Ουσία |
| Μοριακός (μοριακός) τύπος | C8 H8 ΟΧΙ2 |
| Μοριακό (μοριακό) βάρος | 147.13 |
Παρασκευή φθαλιμιδίων
Τα φθαλιμίδια μπορούν να δημιουργηθούν με θέρμανση της δυαδικής ένωσης αμμωνίας και ανυδρίτη.
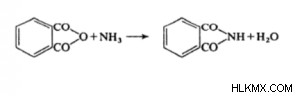
Το φθαλιμίδιο μπορεί επίσης να συντεθεί με θέρμανση ενός μείγματος της χημικής ουσίας και του ανθρακικού. Το φθαλιμίδιο του καλίου δημιουργείται όταν συνδυάζεται με αιθανολική καυστική ποτάσα, η οποία το μετατρέπει σε ήπια όξινο, φθαλιμίδιο.
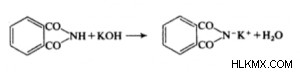
Το μόριο οξέος θα μπορούσε να είναι ένα βασικό ενδιάμεσο στη χημική βιομηχανία. Επιπλέον, παρασκευάζεται εμπορικά με οξείδωση υδρογονανθράκων. Οι υδρογονάνθρακες οξειδώνονται για να δημιουργήσουν το τελικό προϊόν χρησιμοποιώντας θειικό οξύ και καταλύτες υδραργύρου. Το στάδιο ατμού της καύσης μπορεί επίσης να οδηγήσει στην οξείδωση των υδρογονανθράκων. Αν και είναι απλό να δημιουργηθούν ανυδρίτες από οξέα, δεν υπάρχουν τέτοιοι ανυδρίτες στα οξέα ριζών ισορροπίας.
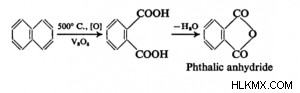
Πληροφοριακές λεπτομέρειεςΤο πιο κρίσιμο βήμα στη σύνθεση φθαλιμιδίων είναι η αφυδατική συρροή φθαλικού ανυδρίτη σε υψηλές θερμοκρασίες όταν είναι προσβάσιμες οι πρωτοταγείς αμίνες. Όταν η αμίνη δεν είναι εύκολα προσβάσιμη, η άμεση Ν-αλκυλίωση των φθαλιμιδίων με χρήση αλκοόλης σε συνθήκες Mitsunobu και το φθαλιμίδιο του καλίου με τη χρήση αλκυλαλογονιδίων (Gabriel Synthesis) είναι οι κοινές εναλλακτικές λύσεις έναντι των προστατευμένων με Ph αμίνες. |
Ιδιότητες φθαλιμιδίου
Φυσικές ιδιότητες
- Οι φθαλιμίδες είναι συμπαγείς και λευκές.
- Το μόριο ζυγίζει 147,33 g ανά mole.
- Το φθαλιμίδιο έχει θερμοκρασίες τήξης και βρασμού 238°C και 336°C, αντίστοιχα.
- Έχει μεγάλη θερμική και ηλεκτρική αγωγιμότητα.
Χημικές ιδιότητες
- Είναι όξινο και έχει επίπεδο pH 8,3.
- Εξασφαλίζεται η σταθερότητα του συντονισμού.
- Το φθαλιμίδιο, το οποίο είναι μια παραλλαγή ιμιδίου, περιέχει ετεροάτομα.
- Όταν έρχεται σε επαφή με μια βάση, δημιουργούνται άλατα.
- Το χαμηλό επίπεδο pH οφείλεται στην παρουσία δύο ηλεκτροφιλικών καρβοξυλίων.
Αντίδραση φθαλιμιδίου
Τα παράγωγα του φθαλικού οξέος δημιουργούνται από την αντίδραση του φθαλικού ανυδρίτη ή του οξέος με αλκοόλη και χρησιμοποιούνται σε αντλίες διάχυσης και για να υποκαταστήσουν τον υδράργυρο σε σωλήνες μανόμετρων. Εστέρες όπως διαιθυλ και διεξύλιο χρησιμοποιούνται συχνά σε αυτήν την εφαρμογή. Τα αποτελεσματικά εντομοαπωθητικά περιλαμβάνουν τον φθαλικό διμεθυλεστέρα. Οι αλκυδικές ρητίνες κατασκευάζονται συχνά χρησιμοποιώντας την ουσία φθαλικός ανυδρίτης. Αυτές οι ρητίνες είναι κατασκευασμένες από πολυυδροξυ αλκοόλες και οξέα που διαθέτουν δύο ομάδες υδροξυλίου. Η αντίδραση φθαλιμιδίου παράγει μεταλλικά άλατα λόγω του όξινου ατόμου υδρογόνου ιμιδαζόλης που βρίσκεται στη μέση των δύο υδροξυλομάδων.
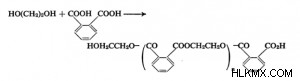
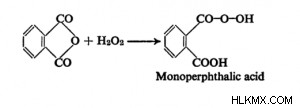
Ίσως γνωρίζετε ότι ο Gabriel παράγει αμίνες και αμινοξέα χρησιμοποιώντας το άλας του φθαλιμιδίου του καλίου. Όπως ήδη αναφέρθηκε, το φθαλιμίδιο μπορεί να διασπαστεί με την αντίδραση Hofmann για να παραχθεί ανθρανιλικό οξύ. Όταν ο φθαλικός ανυδρίτης υποβάλλεται σε επεξεργασία με αλκαλικό υπεροξείδιο σε ψυχρό περιβάλλον, δημιουργείται οξινισμένο μονο-ανυδρικό φθαλικό οξύ.
Χρήσεις φθαλιμιδίου
- Χρησιμοποιείται συχνά στην ιατρική βιομηχανία για τη σύνθεση διαφόρων χημικών μορίων με άζωτο. Χρησιμεύει ως μυστική πηγή αμμωνίας. Προτιμάται λοιπόν η ελεύθερη αμμωνία.
- Χρησιμοποιείται για την παραγωγή ανθρανιλικού οξέος, το οποίο χρησιμοποιείται ευρέως στην επιχείρηση βαφής.
- Είναι ο μοριακός προκάτοχος στη χημική σύνθεση των πεπτιδίων.
- Λόγω των αντιβακτηριακών, αναλγητικών, αντιμυκητιασικών, αντικαρκινικών, αγχολυτικών και αντι-HIV-1 ιδιοτήτων τους, τα φθαλιμίδια έχουν τραβήξει την προσοχή. Η ανάπτυξη φαρμάκων επωφελείται από τις αντιφλεγμονώδεις, αναλγητικές και αντισπασμωδικές του ιδιότητες.
- Το επίκεντρο της τρέχουσας ανασκόπησης αποκαλύπτει ότι μια σημαντική κατηγορία ετεροκυκλικών παραγώγων φθαλιμιδίου έχει την υπόσχεσή της ως αποτελεσματικές θεραπείες για διάφορες ασθένειες, όπως AIDS, όγκοι, διαβήτης, πόνος, πολλαπλό μυέλωμα, σπασμοί, φλεγμονές και βακτηριακές λοιμώξεις. Η ανάπτυξη ικριωμάτων φθαλιμιδίου με εξαιρετικό θεραπευτικό χαρακτηριστικό θα ήταν ένα κρίσιμο πρώτο βήμα στην πιθανή ανάπτυξη φαρμάκων για τη θεραπεία διαφόρων παθήσεων. Αυτές οι εκτεταμένες προσπάθειες θα παράσχουν νέες επιλογές στους ερευνητές για την παραγωγή ανεκτίμητων φαρμακευτικών παραγόντων.
| Η θαλιδομίδη, η κετιμίδη, η αμφοταλίδη και η τριμεθοπρίμη είναι μερικά παραδείγματα φαρμακευτικής αγωγής με φθαλιμίδη. Το Folpet είναι ένα μυκητοκτόνο που προέρχεται από φθαλιμίδιο με τριχλωρομεθυλθειο ομάδα. |
Πληροφοριακές λεπτομέρειεςΜελέτες που χρησιμοποιούν φθαλιμίδες και τα παράγωγά τους έχουν αποκαλύψει ότι αυτές οι ενώσεις έχουν μόνο ήπια επιβλαβή αποτελέσματα όταν χρησιμοποιούνται σε οξεία δόση. Μια δοκιμή θεραπευτικής ασφάλειας διεξήχθη σε μια μελέτη που περιελάμβανε αρυλοφθαλιμίδια και τις υπολιπιδαιμικές και αντιφλεγμονώδεις δραστηριότητές τους για να εξακριβωθεί η οξεία τοξικότητά τους. Ακόμη και στην υψηλότερη δοκιμασμένη δόση των 2 g/kg, δεν υπήρχε καταστροφική δυνατότητα. Τα ζώα επίσης δεν εμφάνισαν σημάδια πιθανών επιπλοκών, όπως αλλαγές συμπεριφοράς όπως συσπάσεις, αναπνοή, δύσπνοια, ακανόνιστους καρδιακούς παλμούς και μειωμένη αναπνευστική λειτουργία. Αυτή η δοκιμή έδειξε ότι οι συνταγογραφούμενες δόσεις για τις βιολογικές λειτουργίες που δοκιμάστηκαν [250 mg/kg] ήταν ασφαλείς. |
Αντίδραση φθαλιμιδίου:Περιορισμοί
Η σύνθεση του διαλύματος διαφέρει ανάλογα με την αναλογία του συστατικού. Ωστόσο, εάν χρησιμοποιείται σημαντική ποσότητα αμμωνίας, η πρωτοταγής αμίνη έχει προτεραιότητα. Η διαδικασία δεν είναι ιδιαίτερα σημαντική όσον αφορά την εφαρμογή γιατί είναι δύσκολο να διαχωριστεί η λύση. Ένα από τα κοινά παραδείγματα αυτής της αντίδρασης είναι η αντίδραση πυρηνόφιλης υποκατάστασης. Επειδή τα σχετικά αλογονοαρένια είναι πολύ λιγότερο αντιδραστικά από τα αλκυλαλογονίδια, επομένως, δεν μπορούν να χρησιμοποιήσουν τη διαδικασία για την παρασκευή ανιλίνης ή άλλων αρωματικών αμινών. Η πυρηνόφιλη ομάδα του NH3 δεν προκαλεί τη θραύση του δεσμού C-X.
Πράγματα που πρέπει να θυμάστε
- Η άνυδρη αμμωνία μπορεί να χρησιμοποιηθεί για την παραγωγή 95% έως 99% φθαλιμιδίου θερμαίνοντας τον άνυδρο ανυδρίτη με αμμωνία.
- Το φθαλιμίδιο είναι μια πρόδρομη ένωση ανθρανιλικού οξέος που χρησιμοποιείται για τη δημιουργία αζωχρωμάτων και ασπαρτάμης.
- Ένα φυσικό ομόλογο της φθαλιμίδης είναι ο ορυκτός κλαδνοΐτης. Μπορεί να βρεθεί μόνο σε λίγους φούρνους κάρβουνου σε όλο τον κόσμο.
- Σε θανατηφόρα δοσολογία, τα φθαλιμίδια είναι σχετικά ήπια τοξικά.
- Τα φθαλιμιδικά άλατα παράγονται όταν το χειριζόμαστε με βάσεις, όπως το υδροξείδιο του νατρίου.
Συμπέρασμα
Τα φθαλιμίδια είναι μια ενδιαφέρουσα κατηγορία χημικών ουσιών με πολλές εφαρμογές μεταξύ των δικυκλικών μη αρωματικών ετεροκύκλων αζώτου. Πολλά διαφορετικά αλκαλοειδή και φαρμακοφόρα έχουν συντεθεί χρησιμοποιώντας φθαλιμίδια ως πρόδρομα υλικά και ενδιάμεσα. Ως αποτέλεσμα των πρόσφατων ευρημάτων, η βιολογική δραστηριότητα του φθαλιμιδίου και ορισμένων από τα παράγωγά του έχει σημαντικές βιολογικές επιδράσεις συγκρίσιμες ή ακόμη μεγαλύτερες από εκείνες γνωστών φαρμακευτικών ενώσεων.
Συχνές ερωτήσεις Phthalimide
Ε1. Ποια λειτουργία εξυπηρετεί το φθαλιμίδιο;
Α: Το φθαλιμίδιο είναι μια οργανική ένωση με χημικό τύπο C6 H4 (CO)2 NH. Είναι παράγωγο αμιδίου του φθαλικού ανυδρίτη. Είναι ένα λευκό στερεό που μπορεί να εξαχνωθεί και είναι ήπια διαλυτό στο νερό αλλά γίνεται περισσότερο όταν προστεθεί η βάση. Χρησιμεύει ως κρυφή πηγή αμμωνίας και είναι προκάτοχος άλλων χημικών μορίων. Στη χημική σύνθεση, τα αλκυλοφθαλιμίδια είναι χρήσιμα δομικά στοιχεία για τις αμίνες, ειδικά στη σύνθεση πεπτιδίων, όπου χρησιμοποιούνται για να «μπλοκάρουν και τα δύο υδρογόνα και να αποτρέψουν την ρακεμοποίηση των υποστρωμάτων.
Ε2. Ορίστε την "ομάδα αμιδίου"
Α: Ένα αμίδιο είναι μια χημική λειτουργική ομάδα αμιδίων που αποτελείται από μια συλλογή καρβονυλίων συνδεδεμένων με ένα άτομο αζώτου. Τα αμίδια μπορούν να συντεθούν από μια αμίνη και ένα καρβοξυλικό οξύ. Επιπλέον, ένα αμίδιο είναι επίσης γνωστό ως ανόργανο ανιόν NH2.
Ε3. Πώς παράγεται το φθαλιμίδιο;
Α: Όταν ο φθαλικός ανυδρίτης και η αλκοολική αμμωνία θερμαίνονται, παράγεται 95–97% φθαλιμίδιο. Εναλλακτικά, μπορεί να γίνει με επεξεργασία του ανυδρίτη με ανθρακικό αμμώνιο ή ουρία. Επιπλέον, μπορεί επίσης να προκληθεί από αμμοξείδωση ο-ξυλενίου.
Ε4. Ποια συστατικά συνθέτουν το φθαλιμίδιο;
Α: Το φθαλιμίδιο είναι μια ιμιδοχημική ένωση του φθαλικού οξέος. Εδώ, το φθαλικό οξύ είναι η κύρια ένωση. Η λέξη «αμίδιο» περιγράφει έναν υποκαταστάτη που μπορεί να φανεί στην οργανική σύνθεση και περιλαμβάνει δύο καρβονυλικές ομάδες δεσμευμένες με άζωτο. Επειδή είναι υδρόφοβα και αδρανή, μπορούν να περάσουν μέσα από τις κυτταρικές μεμβράνες που βρίσκονται in vivo. Αυτές οι ενώσεις έχουν δομικά χαρακτηριστικά με όξινους ανυδρίτες. Ο κύριος όγκος των ιμιδίων δημιουργείται μέσω της σύνθεσης καρβοξυλικών ομάδων και τα ονόματά τους προέρχονται από τα οξέα με τα οποία συντέθηκαν.




