Κανόνες Διαλυτότητας &Διάγραμμα
Η διαλυτότητα είναι ένα από τα πιο ενδιαφέροντα μέρη της χημείας. Η παρακολούθηση ενός πολύχρωμου ιζήματος που σχηματίζεται ή επαναδιαλύεται, μπορεί να είναι πολύ συναρπαστικό. Σε αυτό το άρθρο, εξετάζουμε τους κοινούς κανόνες διαλυτότητας της χημείας, τα οποία δηλώνουν ποια ανιόντα και κατιόντα είναι συνήθως διαλυτά και ποια όχι. Θα εμφανίσουμε επίσης ένα διάγραμμα διαλυτότητας που δηλώνει τη διαλυτότητα πολλών κοινών ιοντικών ενώσεων.
Αυτοί οι κανόνες διαλυτότητας μπορούν να σας βοηθήσουν να προβλέψετε εάν θα σχηματιστεί ίζημα όταν δύο ιοντικές ενώσεις αναμειχθούν σε ένα διάλυμα. Εάν όλοι οι συνδυασμοί ιόντων είναι διαλυτοί, τότε δεν θα σχηματιστεί ίζημα και συχνά δεν μπορείτε να απομονώσετε μία μόνο ένωση.
Κανόνες διαλυτότητας
- Τα άλατα των αλκαλιμετάλλων, συν NH4, είναι συνήθως διαλυτά. Αυτό περιλαμβάνει Li, Na, K, Rb, Cs
- Νιτρικά, με το ΟΧΙ3 ιόντων, είναι πάντα διαλυτά. Το ίδιο και τα οξικά, τα χλωρικά και τα υπερχλωρικά.
- Τα χλωρίδια, τα βρωμίδια και τα ιωδίδια είναι διαλυτά, εκτός από τα Ag, Pb και Hg2
- Οι ενώσεις του αργύρου είναι αδιάλυτες, εκτός από το νιτρικό άργυρο και τον οξικό άργυρο
- Τα θειικά είναι διαλυτά, εκτός από τα Ca, Sr, Ba, Pb και Ag
- Τα υδροξείδια είναι αδιάλυτα, εκτός από τα μέταλλα αλκαλίων που είναι διαλυτά και τα μέταλλα των αλκαλικών γαιών Mg, Ca, Sr, Ba τα οποία είναι ελαφρώς διαλυτά
- Τα σουλφίδια είναι εξαιρετικά αδιάλυτα, εκτός από τα μέταλλα των αλκαλίων και τα μέταλλα των αλκαλικών γαιών
- Τα ανθρακικά είναι αδιάλυτα, εκτός από τα αλκαλικά μέταλλα και το NH4⁺
- Τα χρωμικά είναι αδιάλυτα, εκτός από τα αλκαλικά μέταλλα και το NH4⁺
- Τα φωσφορικά άλατα είναι αδιάλυτα, εκτός από τα μέταλλα αλκαλίων και το NH4⁺
- Τα φθορίδια είναι αδιάλυτα, εκτός από τα μέταλλα αλκαλίων και το NH4⁺
Τι είναι η διαλυτότητα;
Ας συζητήσουμε τη διαλυτότητα και ορισμένους όρους που σχετίζονται με αυτήν.
- Αδιάλυτο – λιγότερο από 1 γραμμάριο διαλύεται σε ένα λίτρο
- Ελαφρά διαλυτό 1-10 γραμμάρια διαλύονται σε ένα λίτρο
- Λεπώς διαλυτά 10-30 γραμμάρια διαλύονται σε ένα λίτρο
- Διαλυτό – περισσότερα από 30 γραμμάρια διαλύονται σε ένα λίτρο
- Ιζήμα – τι βγαίνει από το διάλυμα όταν μια ένωση που σχηματίζεται δεν είναι διαλυτή
- Φίλτρο καφέ – ένας πολύ καλός τρόπος για να διαχωρίσετε το ίζημα σας από το διάλυμα!
- Κορεσμένο διάλυμα – ένα διάλυμα που έχει τη μέγιστη ποσότητα της ένωσης διαλυμένη σε διάλυμα
- Υπερκορεσμένο διάλυμα – διάλυμα που έχει διαλυθεί περισσότερο από το μέγιστο. Αυτό γίνεται συνήθως σχηματίζοντας ένα κορεσμένο διάλυμα σε ζεστό νερό και στη συνέχεια αφήνοντας το διάλυμα να κρυώσει πολύ αργά χωρίς κρυστάλλους σπόρων παρόν
- Διαλύτης – το υγρό που διαλύει την ένωση σας
- Supernate – το διάλυμα που μένει μετά την αφαίρεση ή το φιλτράρισμα ενός ιζήματος
Οι κανόνες διαλυτότητας σε αυτό το άρθρο είναι σε νερό σε θερμοκρασία δωματίου. Ορισμένες ενώσεις μπορεί να έχουν πολύ διαφορετικές διαλυτότητες σε ζεστό ή κρύο νερό. Για παράδειγμα, το βρωμικό κάλιο είναι αρκετά διαλυτό σε ζεστό νερό, αλλά ελαφρώς διαλυτό σε πολύ κρύο νερό.
Ακόμη και οι πιο αδιάλυτες ιοντικές ενώσεις θα διαλυθούν σε ιόντα σε πολύ μικρό βαθμό. Η σταθερά προϊόντος διαλυτότητας, γνωστή ως τιμή Ksp, σας επιτρέπει να υπολογίσετε πόσο πραγματικά θα διαλυθεί.
Ορισμένες ενώσεις μπορεί να χρειαστεί λίγος χρόνος για να διαλυθούν. Για παράδειγμα, οι κρύσταλλοι πενταένυδρου θειικού χαλκού (II) φαίνεται να χρειάζονται για πάντα για να διαλυθούν και ένας μαγνητικός αναδευτήρας πρέπει συχνά να λειτουργεί για να επιταχύνει τα πράγματα.
Ενδιαφέροντα στοιχεία και εξαιρέσεις διαλυτότητας
- Το χλωρικό, το βρωμικό και το υπερχλωρικό κάλιο είναι ελάχιστα διαλυτά σε κρύο νερό. Αυτό το γεγονός μπορεί να χρησιμοποιηθεί για τον διαχωρισμό του καλίου από το νάτριο σε ένα διάλυμα.
- Το οξικό νάτριο είναι τόσο διαλυτό στο νερό, που μπορεί να είναι δύσκολο να σχηματιστεί ένα υπερκορεσμένο διάλυμα
- Το μυρμηκικό ρουβίδιο, το μυρμηκικό θάλλιο και ο υπερχλωρικός άργυρος είναι 3 από τις πιο διαλυτές ενώσεις, με πάνω από 5.000 γραμμάρια από κάθε μία να διαλύονται σε ένα λίτρο νερού σε θερμοκρασία δωματίου!
- Ένα διάλυμα ίσων μερών μυρμηκικού θαλλίου και μηλονικού θαλλίου, και τα δύο εξαιρετικά διαλυτά, είναι γνωστό ως διάλυμα Clerici. Έχει πιθανώς την υψηλότερη πυκνότητα ενός υδατικού διαλύματος. Επιτρέπει τον διαχωρισμό των ορυκτών με βάση την πυκνότητα.
- Τα βρωμικά και τα μυρμηκικά είναι γενικά διαλυτά
- Αλογονίδια χαλκού (Ι) είναι αδιάλυτα, αν και αυτή η εξαίρεση συνήθως δεν αναφέρεται στους τυπικούς κανόνες διαλυτότητας
- Ο μόλυβδος, ο υδράργυρος (II) και ο θειικός άργυρος είναι ελαφρώς διαλυτά
- Τα σουλφίδια είναι ένα από τα πιο αδιάλυτα ιόντα. Για παράδειγμα, όταν χρειάζεται να αφαιρεθεί όλος ο μόλυβδος από το διάλυμα, συχνά προστίθεται θειούχο νάτριο για να καταβυθιστεί όσο το δυνατόν περισσότερος μόλυβδος. Μία από τις πιο αδιάλυτες ιοντικές ενώσεις είναι ο θειούχος υδράργυρος (II).
- Τα οξαλικά είναι εξαιρετικά αδιάλυτα, εκτός από το Na, το K και το NH4 Ακόμη και το ρουβίδιο και το οξαλικό καίσιο είναι αδιάλυτα.
Διάγραμμα διαλυτότητας
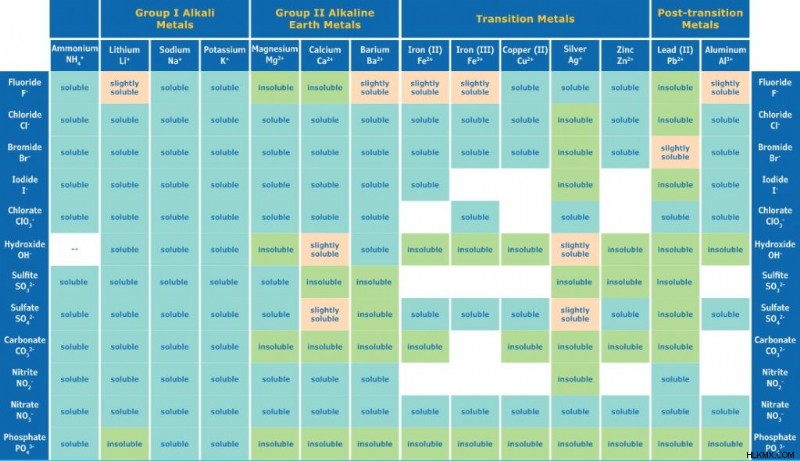
Αυτό το διάγραμμα διαλυτότητας δείχνει τη διαλυτότητα των κοινών ιόντων. Ένα λευκό διάστημα σημαίνει ότι η ένωση δεν είναι σταθερή σε υδατικό διάλυμα. Το γράφημα παρέχεται από τη Sigma. Για πιο ολοκληρωμένο γράφημα, επισκεφτείτε εδώ.
Κανόνες διαλυτότητας – περαιτέρω ανάγνωση
Σταθερές ισορροπίας
Τύποι χημικών αντιδράσεων
Κατιόντα και ανιόντα
Ksp – Σταθερά προϊόντος διαλυτότητας
Βίντεο – παρακολουθείτε μια αδιάλυτη ένωση να πέφτει από το διάλυμα




