Θειικό οξύ:Δομή, Ιδιότητες, Χρήσεις
Έχετε ακούσει για τα οξυοξέα του θείου; Τα οξέα είναι εκείνα τα οξέα που περιέχουν άτομα οξυγόνου. Το θείο σχηματίζει οξυοξέα όπως σουλφοξυλικό οξύ, θειικό οξύ, θειικό οξύ, υπεροξυ-θειικό οξύ, θειονικό οξύ, κ.λπ. Μπορείτε να πείτε ποιο είναι το χαμηλότερο μέλος αυτών των οξυοξέων του θείου; Ποιες είναι οι ιδιότητες και η δομή του; Ποιες είναι οι χρήσεις του; Αυτή η ενότητα αφορά το χαμηλότερο μέλος των θειούχων οξοξέων.
Τι είναι το θειικό οξύ;
Το θείο είναι γνωστό για τον μεγάλο αριθμό οξυοξέων του. Αυτά τα οξέα υπάρχουν είτε στην ελεύθερη τους κατάσταση, με τη μορφή του διαλύματός τους, είτε ως άλατά τους.
Τώρα, για να απαντήσουμε στο ερώτημα, τι είναι το θειικό οξύ; Με απλά λόγια, μπορούμε να πούμε ότι είναι ένα από τα οξυοξέα του θείου. Τα οξυοξέα του θείου ταξινομούνται σε τρεις σειρές. Μεταξύ αυτών των τριών σειρών, η μία είναι σειράς θειικού οξέος.
Το λιγότερο ισχυρό είναι το θειικό οξύ. Το διάλυμα διοξειδίου του θείου είναι ένα άλλο όνομα για το θειικό οξύ. Ένα διβασικό οξύ, δηλαδή. Στο θειικό οξύ, το άτομο S βρίσκεται σε κατάσταση οξείδωσης +4. Δεδομένου ότι αυτό το οξύ είναι ασταθές, δεν μπορεί να βρεθεί στην ελεύθερη του μορφή. Μόνο σε λύση εννοείται.
Δομή θειικού οξέος
Ο μοριακός τύπος του θειικού οξέος είναι H2SO3. Μπορεί επίσης να γραφτεί ως OS(OH)2. Η δομή του θειικού οξέος δίνεται παρακάτω:
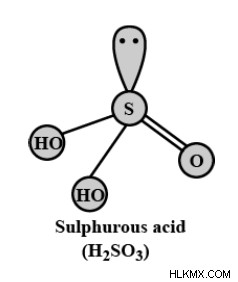
Το H2SO3 είναι γνωστό ως διάλυμα διοξειδίου του θείου, τριοξοθειικό διόξινο ή τριοξοθειικό οξύ. Σύμφωνα με τους κανόνες της δομής κουκκίδας Lewis, το άτομο S με τη χαμηλότερη ηλεκτραρνητικότητα στο μόριο βρίσκεται στο κέντρο της δομής. Υπάρχουν δύο δομές θειούχου οξέος, όπως προτείνουν οι χημικοί. Αυτά είναι
1. Συμμετρική δομή:
Τρία άτομα Ο περιβάλλουν το άτομο S σε μια συμμετρική δομή θειούχου οξέος. Δύο άτομα Η συνδέονται με δύο άτομα Ο σχηματίζοντας ομάδες υδροξειδίου. Και ένα άτομο Ο σχηματίζει έναν διπλό δεσμό ή έναν δεσμό συντεταγμένων με το άτομο S.
2. Ασυμμετρική δομή:
Σε μια ασύμμετρη δομή θειούχου οξέος, το άτομο S περιβάλλεται από τρία άτομα Ο και ένα άτομο Η. Το υπόλοιπο άτομο Η συνδέεται με οποιοδήποτε άτομο Ο σχηματίζοντας μια ομάδα υδροξειδίου. Και τα άλλα δύο άτομα Ο σχηματίζουν δύο διπλούς ή συντεταγμένους δεσμούς με το άτομο S.
Κανονικά, και οι δύο δομές θειούχου οξέος υπάρχουν σε συντονισμό μεταξύ τους. Η γεωμετρία του θειικού οξέος είναι τριγωνική πυραμιδική.
Παρασκευή Θειικού Οξέος
Το θειικό οξύ πιστεύεται ότι είναι ένα διάλυμα SO2 σε νερό. Υπάρχουν δύο τρόποι παρασκευής θειικού οξέος. Αυτά είναι
Μέθοδος 1: Χρησιμοποιώντας διοξείδιο του θείου.
Το διάλυμα του οξέος λαμβάνεται με διάλυση SO2 σε νερό.
SO2 + H2O → H2SO3
Μέθοδος 2: Χρησιμοποιώντας θειονυλοχλωρίδιο.
Το H2SO3 μπορεί επίσης να παρασκευαστεί με τη δράση του νερού σε θειονυλοχλωρίδιο, SOCl2.
SOCl2 + 2H2O → H2SO3 + 2HCl
Ιδιότητες θειικού οξέος
Ο κατάλογος ορισμένων ιδιοτήτων θειικού οξέος δίνεται παρακάτω:
- Το διάλυμα θειούχου οξέος δίνει μια μυρωδιά SO2, η οποία αναπτύχθηκε κατά τη θέρμανση του διαλύματος. Επομένως, το H2SO3 είναι παρόν σε ισορροπία με το ελεύθερο αέριο SO2.
H2SO3 ⇌ H2O + SO2
- Όταν ένα κορεσμένο διάλυμα SO2 σε H2O ψύχεται στους 3℃, διαχωρίζονται οι κρύσταλλοι εξαένυδρου, SO2.6H2O.
- Όξινη φύση: Δείχνει διβασική φύση.
H₂SO3 ⇌ H⁺ + HSO₃-
HSO₃⁻ ⇌ H⁺ + SO₃²⁻
- Αποσύνθεση: Όταν το διάλυμα θειικού οξέος θερμαίνεται σε σφραγισμένο σωλήνα στους 150℃, εναποτίθεται θείο.
3H2SO3 → 2H2SO4 + H2O + S
- Μείωση ιδιοτήτων: Δρα ως ισχυρός αναγωγικός παράγοντας. Όταν μειώνει μια συγκεκριμένη ουσία, το θειικό οξύ οξειδώνεται σε H2SO4 και δίνει υδρογόνο.
H2SO3 + H2O → H2SO4 + 2[H]
- Οξειδωτικές ιδιότητες: Λειτουργεί επίσης ως οξειδωτικός παράγοντας. Όταν οξειδώνει μια συγκεκριμένη ουσία, στις περισσότερες περιπτώσεις ανάγεται σε θείο.
H2SO3 → S + H2O + 2[O]
- Ιδιότητες λεύκανσης: Καθώς δρα ως αναγωγικός παράγοντας, μπορεί να απελευθερώσει εύκολα το εκκολαπτόμενο υδρογόνο. Αυτό το εκκολαπτόμενο υδρογόνο μπορεί να μετατρέψει την έγχρωμη ύλη σε άχρωμη ύλη, δηλαδή το H2SO3 δρα ως λευκαντικός παράγοντας.
H2SO3 + H2O → H2SO4 + 2[H]
- Τα μόρια H2SO3 μπορούν εύκολα να προσλάβουν άτομα οξυγόνου και θείου για να σχηματίσουν H2SO4 και H2S2O3 (θειοθειικό οξύ).
H2SO3 + [O] → H2SO4
H2SO3 + [S] → H2S2O3
- Δράση της σκόνης Zn: Όταν το H2SO3 θερμαίνεται με σκόνη Zn, λαμβάνεται υποθειώδης ψευδάργυρος (ZnS2O4).
H2SO3 + Zn → ZnS2O4 + 2H2O
Ορισμένες άλλες χημικές αντιδράσεις θειούχου οξέος
- Το H2SO3 ανάγει τα αλογόνα (X) στα αντίστοιχα υδροξέα τους (HX).
H2SO3 + H2O + X2 → H2SO4 + 2HX
- Το οξινισμένο διάλυμα KMnO4 ανάγεται στο διάλυμα MnSO4.
2KMnO4 + 5H2SO3 → K2SO4 + 2MnSO4 + 2H2SO4 + 3H2O
- Το οξινισμένο διάλυμα K2Cr2O7 γίνεται πράσινο λόγω του σχηματισμού Cr2(SO4)3.
K2Cr2O7 + H2SO4 + 3H2SO3 → K2SO4 + Cr2(SO4)3 + 4H2O
- Το θειικό οξύ μειώνει το Fe2(SO4)3 σε FeSO4.
H2SO3 + H2O + Fe2(SO4)3 → 2H2SO4 + 2FeSO4
- Μειώνει το οξινισμένο διάλυμα ιωδικού σε I2.
5H2SO3 + 2KIO3 → 4H2SO4 + K2SO4 + H2O + I2
- Το θειικό οξύ οξειδώνει το H2S σε S και ανάγεται σε S.
H2SO3 + 2H2S → 3S + 3H2O
- Στους 1000℃, το H2 οξειδώνεται σε H2O και το H2SO3 ανάγεται σε S.
H2SO3 + 2H2 → S + 3H2O
- Το H2SO3 ανάγεται σε θείο ενώ οξειδώνει το SnCl2 και το Hg2Cl2 σε SnCl4 και HgCl4, αντίστοιχα.
H2SO3 + 2SnCl2 + 4HCl → S + 3H2O + 2SnCl4
H2SO3 + 2Hg2Cl2 + 4HCl → S + 3H2O + 4HgCl2
Εξουδετερωτικό Θειικό Οξύ
Η διαδικασία εξουδετέρωσης του σουλφονικού οξέος πραγματοποιείται με τους εξής τρόπους:
- Ρίξτε αργά σουλφονικό οξύ στο υδατικό διάλυμα υδροξειδίου των αλκαλίων. Ανακατεύετε συνεχώς το διάλυμα ενώ προσθέτετε το οξύ.
Σε εμπορικές δραστηριότητες, αυτή η διαδικασία μπορεί να πραγματοποιείται κατά διαστήματα ή συνεχώς.
- Σε θερμοκρασία δωματίου ή υπό κανονικές συνθήκες, το θειικό οξύ αντιδρά με ανθρακικά αλκύλιο. Και εξουδετερώνει το θειικό οξύ.
- Ένα διάλυμα καυστικής σόδας 50% μπορεί επίσης να εξουδετερώσει το θειικό οξύ. Μια κιτρινωπή πάστα λαμβάνεται με αντίδραση 50% διαλύματος καυστικής σόδας με θειικό οξύ.
Χρήσεις θειικού οξέος
Υπάρχουν πολύ λίγα για να αποδειχθεί η ύπαρξη θειικού οξέος, επομένως υπάρχουν ορισμένες χρήσεις θειικού οξέος. Αυτά είναι
- Το θειικό οξύ είναι ένας ισχυρός αναγωγικός παράγοντας. Έχει μια κατάσταση οξείδωσης +4 που μπορεί να οξειδωθεί έως και +6 όταν το θειικό οξύ μειώνει άλλες ουσίες.
- Μπορεί να μειώσει το χλώριο σε υδροχλωρικό οξύ.
- Μπορεί να οξειδωθεί σε θειικό ή θειικό οξύ δεχόμενο άλλο άτομο οξυγόνου.
- Χρησιμοποιείται για τη λεύκανση άχυρου και προϊόντων από χαρτί, όπως καπέλα και σακούλες.
- Χρησιμοποιείται ως καλός απολυμαντικός παράγοντας.
Τοξικότητα θειώδους οξέος
Εκτός από τις χρήσεις θειικού οξέος, υπάρχουν ορισμένα θέματα τοξικότητας. Σε ανεπιθύμητες περιπτώσεις,
- Μπορεί να είναι δερματική τοξίνη και να προκαλέσει εγκαύματα στο δέρμα.
- Μπορεί επίσης να προκαλέσει φλεγμονή των πνευμόνων που επηρεάζεται από την εισπνοή τοξικών αερίων και ατμών ή αναθυμιάσεων μετάλλων.
- Μπορεί επίσης να προκαλέσει γαστρεντερικά προβλήματα όπως διάρροια, υπερκινητικότητα κ.λπ.
- Κάποιες περιπτώσεις καταγράφονται όταν οι άνθρωποι εμφανίζουν ναυτία ή έμετο μετά την εισπνοή αναθυμιάσεων θειικού οξέος.
Σημεία που πρέπει να θυμάστε σχετικά με το θειικό οξύ
- Η καθαρή του μορφή δεν είναι διαθέσιμη.
- Πρόκειται για ένα φτωχό ανόργανο οξύ που είναι γνωστό ως θεραπεία kituo.
- Θεωρείται διάλυμα διοξειδίου του θείου στο νερό.
- Έχει τριγωνική πυραμιδική δομή.
- Το διάλυμά του δίνει τη μυρωδιά του SO2.
- Υπάρχει σε μορφή διαλύματος.
- Είναι ταυτομερές του σουλφονικού οξέος.
- Με το κάψιμο, δίνει μια πικάντικη οσμή θείου.
- Λαμβάνεται επίσης με αντίδραση SOCl2 με νερό.
- Με θέρμανση στους 150℃, μπορεί να αποσυντεθεί σε νερό, θειικό οξύ και θείο.
- Το κύριο συστατικό του θειικού οξέος είναι η όξινη βροχή.
- Το σημείο βρασμού του H2SO3 είναι -60℃.
- Είναι διαβρωτικό σε ιστούς και μέταλλα.
- Είναι διπρωτικό οξύ και μπορεί να δώσει δύο πρωτόνια, δηλαδή δύο ιόντα Η+.
- Είναι το συζυγές οξύ του υδρόθειου.
- Η μοριακή μάζα του θειικού οξέος είναι 82,07 g/mol.
Συμπέρασμα
Συμπερασματικά, το θειικό οξύ είναι ένα οξοοξύ του θείου. Κανένα άμεσο έγγραφο δεν αποδεικνύει την ύπαρξη αυτού του οξέος σε διαλύματα, αλλά το μόριο έχει ανιχνευθεί στην αέρια φάση. Το θειικό οξύ είναι ένα λειαντικό οξοξύ θείου και μια ταυτομερής μορφή σουλφονικού οξέος. Επειδή το καθαρό, άνυδρο θειικό οξύ (H2SO3) δεν μπορεί να περιγραφεί, τα υδατικά διαλύματα διοξειδίου του θείου αναφέρονται συχνά ως θειικό οξύ.
Χρησιμοποιούνται ως αναγωγικά και απολυμαντικά. Καθώς απελευθερώνει καρκινογόνους ατμούς θείου, οι οποίοι είναι τοξικοί, το θειικό οξύ είναι ένα καρκινογόνο οξύ του θείου. Εάν εισπνεύσετε τις αναθυμιάσεις του ή έρθετε σε επαφή με θειικό οξύ, είναι απαραίτητο να ζητήσετε ιατρική συμβουλή.
Συχνές ερωτήσεις
1. Το θειικό οξύ είναι ισχυρό ή αδύναμο;
Α. Τα αδύναμα οξέα διασπώνται εν μέρει στο νερό, με αποτέλεσμα μια κατάσταση ισορροπίας που περιέχει το ασθενές οξύ και τα ιόντα του. Το H2SO3 στην υδατική κατάσταση δεν διασπάται πλήρως σε H3O+ ή H+ και όξινα θειώδες ιόντα. Σημαίνει ότι το διθειώδες ιόν είναι σχετικά ισχυρότερο στη διατήρηση ενός πρωτονίου (H+) όταν υπάρχει μια βάση, για παράδειγμα, νερό. Ως εκ τούτου, το θειικό οξύ (H2SO3) είναι ένα ασθενές οξύ.
2. Το θειικό οξύ προκαλεί κινδύνους για την υγεία;
Α. Το θειικό οξύ είναι μια διαβρωτική χημική ουσία. Εκτός από τις χρήσεις του, το θειικό οξύ προκαλεί ορισμένους κινδύνους για την υγεία.
- Η άμεση επαφή με θειικό οξύ μπορεί να προκαλέσει σοβαρό ερεθισμό και κάψιμο του δέρματος.
- Μπορεί να προκαλέσει ακόμη και βλάβη στα μάτια σας.
- Κατά την εισπνοή, το θειικό οξύ μπορεί να ερεθίσει το λαιμό και τη μύτη σας.
- Αναπνέοντας θειικό οξύ, H2SO3 μπορεί να ερεθίσει τους πνεύμονές σας.
- Μπορεί επίσης να προκαλέσει βήχα ή δύσπνοια.
3. Ποιο είναι το ισχυρότερο οξύ:θειικό οξύ ή θειικό οξύ;
Α. Το θειικό οξύ (H2SO3) και το θειικό οξύ είναι διπρωτικά οξέα, τα οποία καταλήγουν σε δύο πρωτόνια (H+) κατά τη διαίρεση. Ακόμα, το θειικό οξύ (H2SO4) είναι ένα ισχυρό οξύ. Είναι επειδή η πρώτη διάσταση πρωτονίων είναι πιο ευνοϊκή σε αυτήν σε σύγκριση με το H2SO3.




