Νιτρικό Οξείδιο – Τύπος, Δομή, Ιδιότητες &Οφέλη
Το μονοξείδιο του αζώτου ή ΝΟ είναι ένα άχρωμο οξείδιο του αζώτου. Αυτή η αέρια ένωση περιλαμβάνει ασύζευκτα ηλεκτρόνια και ανήκει στα ετεροπυρηνικά διατομικά μόρια. Ονομάζεται επίσης μονοξείδιο του αζώτου. Βρίσκεται στα ανθρώπινα κύτταρα και έχει πολλά οφέλη για την υγεία. Δεν πρέπει να συγχέετε το μονοξείδιο του αζώτου με το διοξείδιο του αζώτου (NO2 ), σημαντικός ατμοσφαιρικός ρύπος ή με οξείδιο του αζώτου (N2 Ο), ένα αναισθητικό. Οι ακόλουθες ενότητες διερευνούν τον τύπο του μονοξειδίου του αζώτου, τις ιδιότητες και τα οφέλη του μονοξειδίου του αζώτου.
Τι είναι το μονοξείδιο του αζώτου;
Το μονοξείδιο του αζώτου είναι ένα μόριο που περιέχει άζωτο και οξυγόνο. Είναι διατομική και εμφανίζεται ως ελεύθερη ρίζα. Το μονοξείδιο του αζώτου εμφανίζεται στα συστήματα καύσης. Μπορεί να δημιουργηθεί από κεραυνούς σε καταιγίδες. Εμφανίζεται επίσης στα θηλαστικά ως σηματοδοτικό μόριο σε διάφορες φυσιολογικές και παθολογικές διεργασίες.
Το μονοξείδιο του αζώτου είναι επίσης ένας τοξικός ατμοσφαιρικός ρύπος που εκπέμπεται από κινητήρες αυτοκινήτων και σταθμούς παραγωγής ενέργειας. Οι ανθρωπογενείς πηγές εκπομπών περιλαμβάνουν:
- Σταθμοί ενέργειας
- Διαδικασίες καύσης τόσο οικιακές όσο και εμπορικές
- Μηχανοκίνητα οχήματα
- Οδικές μεταφορές
- Θερμαντήρες χώρου κηροζίνης
- Κάπνισμα καπνού
Όταν το άζωτο υφίσταται οξείδωση, οδηγεί σε σχηματισμό μονοξειδίου του αζώτου. Υποκινείται από την προσθήκη ηλεκτρικών σπινθήρων ή θερμότητας. Εμφανίζεται η ακόλουθη αντίδραση:
N2 + O2 → 2 ΟΧΙ
Τύπος και δομή μονοξειδίου του αζώτου
Ο τύπος του μονοξειδίου του αζώτου είναι ΟΧΙ. Έτσι, το μονοξείδιο του αζώτου ονομάζεται επίσης:
- Οξείδιο του αζώτου(II)
- Oxonitrogen
- Οξείδιο του αζώτου
- Μονοξείδιο του αζώτου (όνομα IUPAC)
Είναι μια ελεύθερη ρίζα με ένα ασύζευκτο ηλεκτρόνιο. Επομένως, μερικές φορές γράφεται με μια τελεία που υποδηλώνει το μη ζευγαρωμένο ηλεκτρόνιο ως εξής:
- N=O ή •NO
Η δομή κουκκίδων lewis του μονοξειδίου του αζώτου δίνει περαιτέρω πληροφορίες για την κατανομή των ηλεκτρονίων.
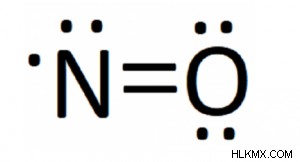
Η δομή δείχνει ότι το μονοξείδιο του αζώτου περιέχει:
- Δύο διπλοί δεσμοί
- Τρία μεμονωμένα ζεύγη ηλεκτρονίων
- Ένα μη ζευγαρωμένο ηλεκτρόνιο στο άζωτο
Παρασκευή μονοξειδίου του αζώτου
Έχουν χρησιμοποιηθεί διάφορες μέθοδοι για τη λήψη μονοξειδίου του αζώτου στο εργαστήριο και σε εμπορικούς χώρους. Μερικές από τις πιο ευρέως αποδεκτές μεθόδους είναι οι εξής:
Μείωση του νιτρικού οξέος με χαλκό
Στα εργαστήρια, το μονοξείδιο του αζώτου παρασκευάζεται με την αναγωγή του αραιού ΗΝΟ3 με χαλκό. Η αντίδραση προχωρά ως εξής:
8 HNO3 + 3 Cu → 3 Cu(NO3 )2 + 4 H2 O + 2 ΟΧΙ
Από νιτρώδες νάτριο
2 NaNO2 + 2 FeSO4 + 3 H2 SO4 → Fe2 (SO4 )3 + 2NaHSO, + 2H2 O + 2 ΟΧΙ
Από Νιτρώδες Κάλιο
Μια εναλλακτική οδός περιλαμβάνει την αναγωγή του νιτρώδους οξέος με τη μορφή νιτρώδους νατρίου ή νιτρώδους καλίου:
3 KNO2 + KNO3 + Cr2 O, → 2 K2 CrO4 + 4 ΟΧΙ
Διαδικασία του Ostwald
Σε εμπορικά περιβάλλοντα, η διαδικασία του Ostwald βοηθά στην παραγωγή μονοξειδίου του αζώτου όταν η αμμωνία οξειδώνεται στους 750–900 °C παρουσία πλατίνας ως καταλύτη:
4 NH3 + 5 O2 → 4 ΟΧΙ + 6 Η2 O
Ιδιότητες του μονοξειδίου του αζώτου
Το μονοξείδιο του αζώτου περιλαμβάνει άζωτο και οξυγόνο. Επομένως, η μοριακή του μάζα είναι το άθροισμα των ατομικών μαζών αζώτου και οξυγόνου. Η μοριακή μάζα είναι 30 g. Είναι ένα άοσμο αέριο. Ωστόσο, η στερεά και η υγρή του κατάσταση είναι μπλε. Είναι ένα πολύ αντιδραστικό μόριο λόγω της παρουσίας περιττού αριθμού ηλεκτρονίων. Οι σημαντικές ιδιότητες του μονοξειδίου του αζώτου αναφέρονται παρακάτω:
- Μοριακή μάζα:30,006 g·mol−1
- Εμφάνιση:Άχρωμη
- Κατάσταση:Αέριο
- Πυκνότητα:1,3402 g/L:
- Σημείο τήξεως:−164 °C (−263 °F, 109 K)
- Σημείο βρασμού:−152 °C (−242 °F, 121 K)
- Διαλυτότητα στο νερό:0,0098 g / 100 ml (0 °C)
- Δείκτης διάθλασης:1
- Μοριακό σχήμα:Γραμμικό
Χημικές αντιδράσεις ΝΟ
Το μονοξείδιο του αζώτου ή το μονοξείδιο του αζώτου αντιδρά με το οξυγόνο και άλλα μόρια για να δημιουργήσει διάφορα διαφορετικά προϊόντα. Ακολουθούν μερικά από τα σημαντικά χημικά κλάσματα που περιλαμβάνουν ΝΟ.
Συμπύκνωση
Το μονοξείδιο του αζώτου συμπυκνώνεται σε υγρό και διμερίζεται σε διοξείδιο του αζώτου. Ωστόσο, αυτή η συσχέτιση είναι αδύναμη και αναστρέψιμη. Η απόσταση μεταξύ των ατόμων N–N στο κρυσταλλικό ΝΟ είναι 218 pm. Είναι σχεδόν διπλάσια από την απόσταση μεταξύ N–O.
Αποσύνθεση
Η αποσύνθεση του μονοξειδίου του αζώτου είναι ενδόθερμη. Αποσυντίθεται στα συστατικά του στοιχεία – άζωτο και οξυγόνο.
2 ΟΧΙ → O2 + N2
Οξείδωση
Το μονοξείδιο του αζώτου μετατρέπεται σε διοξείδιο του αζώτου όταν εκτίθεται στο οξυγόνο. Η ισορροπημένη χημική εξίσωση για την αντίδραση είναι η εξής:
2 ΟΧΙ + O2 → 2 ΟΧΙ2
Αντίδραση με νερό
Το μονοξείδιο του αζώτου αντιδρά με το οξυγόνο και το νερό για να σχηματίσει νιτρώδες οξύ. Η ισορροπημένη χημική αντίδραση αναφέρεται παρακάτω:
4 ΟΧΙ + O2 + 2 H2 O → 4 HNO2
Αντίδραση με αλογονίδια
Το μονοξείδιο του αζώτου συνδυάζεται με αλογονίδια όπως φθόριο, χλώριο και βρώμιο για να παράγει νιτροζυλαλογονίδια. Η αντίδρασή του με το χλώριο αναφέρεται παρακάτω:
2 ΟΧΙ + Cl2 → 2 NaCl
Αντίδραση με διοξείδιο του αζώτου
Αντιδρά με το διοξείδιο του αζώτου, μια ρίζα για να σχηματίσει το έντονα μπλε τριοξείδιο του αζώτου. Η ισορροπημένη χημική εξίσωση για την αντίδραση είναι η εξής:
ΟΧΙ + ΟΧΙ2 ⇌ ON−NO2
Νιτροζυλίωση
Το τμήμα του μονοξειδίου του αζώτου, όταν προστίθεται σε άλλο μόριο, η διαδικασία ονομάζεται νιτροζυλίωση. Αυτή η ομοιοπολική ενσωμάτωση σε άλλο οργανικό μόριο ενσωματώνει αρκετούς χημικούς μηχανισμούς.
Οφέλη για την υγεία του μονοξειδίου του αζώτου
Το μονοξείδιο του αζώτου παράγεται στα ανθρώπινα κύτταρα και είναι μια σημαντική ένωση για την υγεία των αιμοφόρων αγγείων. Χρησιμεύει ως αγγειοδιασταλτικό, δηλαδή χαλαρώνει τους εσωτερικούς μύες των αιμοφόρων αγγείων και τους διευρύνει. Επομένως, αυξάνει τη ροή του αίματος και μειώνει την αρτηριακή πίεση.
Τα κύρια οφέλη του μονοξειδίου του αζώτου για την υγεία είναι τα εξής:
- Μπορεί να μειώσει τον μυϊκό πόνο:Έχει χαλαρωτική επίδραση στα κύτταρα και τους μύες.
- Σηματοδότηση:Λειτουργεί ως σηματοδοτικό μόριο ή αγγελιοφόρος στο νευρικό, το καρδιαγγειακό και το ανοσοποιητικό σύστημα.
- Αγγειοδιαστολή:Λειτουργεί ως αντιστηθαγχικό φάρμακο και επιφέρει τη διαστολή των αιμοφόρων αγγείων. Είναι αποτελεσματικό στην ανακούφιση του πόνου στο στήθος.
- Βρογχοδιαστολή:Το μονοξείδιο του αζώτου βοηθά επίσης στη θεραπεία των μυών στους αεραγωγούς. Χαλαρώνει τους βρόγχους σε ασθενείς με άσθμα.
- Συτική δυσλειτουργία:Μπορεί να βοηθήσει στη θεραπεία της στυτικής δυσλειτουργίας στους άνδρες όταν λαμβάνεται ως συμπλήρωμα.
- Αρτηριακή πίεση:Βοηθά στη μείωση της αρτηριακής πίεσης σε ασθενείς διαστέλλοντας τα αγγεία.
- Απόδοση άσκησης:Ενισχύει την απόδοση άσκησης σε αθλητές και άτομα που πηγαίνουν στο γυμναστήριο αναψυχής
- Διαβήτης:Βοηθά στη διαχείριση του διαβήτη τύπου 2 καθώς το μονοξείδιο του αζώτου είναι ένα σημαντικό ρυθμιστικό μόριο στις μεταβολικές, αγγειακές και κυτταρικές διεργασίες.
Περιβαλλοντική συμμετοχή στο μονοξείδιο του αζώτου
Το μονοξείδιο του αζώτου συμμετέχει στην όξινη βροχή και στην καταστροφή του όζοντος. Έτσι, επηρεάζει το περιβάλλον.
Εναπόθεση όξινης βροχής
Σε αντίδραση με ρίζα υδροϋπεροξυλίου (HO2 •), το μονοξείδιο του αζώτου σχηματίζει διοξείδιο του αζώτου (NO2). ).
- NO + HO2 •→ •ΟΧΙ2 + •OH
Στη συνέχεια, το διοξείδιο του αζώτου αντιδρά με μια ρίζα υδροξυλίου (•OH) για να δημιουργήσει νιτρικό οξύ ως εξής:
- ΟΧΙ2 + •OH → HNO3
Το νιτρικό οξύ και άλλα οξέα, όταν σχηματίζονται στην ατμόσφαιρα, συμβάλλουν στην εναπόθεση όξινης βροχής. Η όξινη βροχή έχει σοβαρές καταστροφικές επιπτώσεις στα ακόλουθα:
- Κτίρια
- Βλάστηση
- Υλικά
- Οξίνιση των χερσαίων οικοσυστημάτων
- Οξίνιση της υδρόβιας ζωής
- Αναπνευστικές επιπτώσεις σε ζώα και ανθρώπους
Το μονοξείδιο του αζώτου κάνει τον αέρα μουντό, υποδηλώνοντας ατμοσφαιρική ρύπανση. Δημιουργεί μια κοκκινοκαφέ ομίχλη.
Εξάντληση του όζοντος
Το μονοξείδιο του αζώτου συμμετέχει επίσης στην καταστροφή του στρώματος του όζοντος. Αντιδρά με το όζον της στρατόσφαιρας και το διασπά σε οξυγόνο και διοξείδιο του αζώτου. Το να είσαι ελεύθερη ρίζα προκαλεί την ακόλουθη αντίδραση:
- NO + O3 → ΟΧΙ2 + O
Καθώς το στρώμα του όζοντος καταστρέφεται, οι επιβλαβείς ακτίνες UV του ήλιου εισχωρούν στη γη και προκαλούν καταστροφικές επιπτώσεις στους ανθρώπους και στο περιβάλλον.
Πώς να μειώσετε το μονοξείδιο του αζώτου;
Ο καλύτερος τρόπος για τη μείωση των εκπομπών μονοξειδίου του αζώτου είναι ο καθορισμός περιφερειακών και εθνικών προτύπων και η διασφάλιση της επιβολής τους. Οι πολίτες πρέπει να τηρούν τις κατευθυντήριες γραμμές που θέτει η κυβέρνηση. Η διαδικασία απαιτεί αποτελεσματική παρακολούθηση της περιοχής.
Η υιοθέτηση ενεργειών καθαρού αέρα και η παρακολούθηση των επιπέδων του μονοξειδίου του αζώτου είναι ζωτικής σημασίας. Αυτή η πρακτική θα βοηθούσε στον εντοπισμό περιοχών που δεν πληρούν τα εθνικά πρότυπα. Κατά συνέπεια, μπορούν να εξεταστούν πιο κατάλληλες παρεμβάσεις για τη διασφάλιση ενός καλύτερου και πιο υγιεινού περιβάλλοντος.
Γενικά, οι άνθρωποι πρέπει να προσπαθήσουν να μειώσουν τις εκπομπές καύσης όσο το δυνατόν περισσότερο και να υιοθετήσουν πρακτικές φιλικές προς το περιβάλλον.
Συμπέρασμα
Το μονοξείδιο του αζώτου έχει τον χημικό τύπο ΟΧΙ. Εμφανίζεται σε αέρια κατάσταση και είναι ένα πολύ αντιδραστικό μόριο. Είναι μια σημαντική ελεύθερη ρίζα που συμμετέχει σε διάφορες χημικές αντιδράσεις στην ατμόσφαιρα και στο ανθρώπινο σώμα. Μέσα στον άνθρωπο και σε άλλα θηλαστικά έχει ευεργετικά αποτελέσματα. Ωστόσο, όταν υπάρχει στην ατμόσφαιρα, μπορεί να συμβάλει στην καταστροφή του στρώματος του όζοντος και στην όξινη βροχή.
Συχνές ερωτήσεις
1. Ποιες είναι οι βιολογικές λειτουργίες του μονοξειδίου του αζώτου;
Το μονοξείδιο του αζώτου χρησιμεύει ως αέριο σηματοδοτικό μόριο στα σπονδυλωτά. Είναι βιοπροϊόν σε όλους σχεδόν τους τύπους οργανισμών. Είναι ένας χαλαρωτικός παράγοντας. Επίσης, η πρόσδεσή του στην περιοχή αίμης του ενζύμου γουανυλυλοκυκλάσης οδηγεί στην ενεργοποίηση του ενζύμου. Το εξαιρετικά αντιδραστικό μόριο, το ΝΟ, διαχέεται ελεύθερα στις μεμβράνες. Επιφέρει χαλάρωση στους λείους μύες των αιμοφόρων αγγείων, με αποτέλεσμα αγγειοδιαστολή και αυξημένη ροή αίματος.
2. Πού παράγεται το ΟΧΙ στον οργανισμό;
Το ΝΟ μπορεί να παραχθεί σε σημαντικές ποσότητες από τα λευκά αιμοσφαίρια. Είναι ενδιαφέρον ότι η ρινική αναπνοή παράγει μονοξείδιο του αζώτου, αλλά η στοματική αναπνοή όχι.
3. Ποια είναι η επίδραση του εισπνεόμενου μονοξειδίου του αζώτου στην υγεία;
Τα ακόλουθα αναπνευστικά συμπτώματα παρατηρούνται κατά την έκθεση στο μονοξείδιο του αζώτου:
- Βήχας
- Συριγμός
- Δυσκολία στην αναπνοή
- Ανάπτυξη άσθματος
- Αίσθηση καύσου
- Σπασμοί
- Οίδημα ιστών στο λαιμό
- Η συσσώρευση υγρού στους πνεύμονες
4. Είναι το μονοξείδιο του αζώτου τοξικό για τον άνθρωπο;
Τα οξείδια του αζώτου είναι ερεθιστικά για την αναπνευστική οδό και τους πνεύμονες του ανθρώπου όταν εισπνέονται, ακόμη και σε χαμηλές συγκεντρώσεις. Μια ή δύο αναπνοές πολύ υψηλής συγκέντρωσης μπορεί να οδηγήσει σε σοβαρή τοξικότητα.