Θειικό Οξύ – Μοριακή Μάζα, Δομή, Ιδιότητες &Χρήσεις
Το H2 SO4 Το όνομα του οξέος είναι θειικό οξύ. Είναι ένα πολύ διαβρωτικό διπρωτικό επειδή έχει δύο πρωτόνια οξέων. Με άλλα λόγια, περιέχει ένα θειικό μόριο συνδεδεμένο με τα όξινα πρωτόνια Η. Αυτό το οξύ απαιτεί τη μέγιστη προσοχή όσων το χειρίζονται καθώς είναι καταστροφικό για το δέρμα, τα δόντια, τα μάτια και τους πνεύμονες. Η παρατεταμένη έκθεση μπορεί να οδηγήσει ακόμη και σε θάνατο. Συχνά οι επιβλαβείς επιπτώσεις του παρατηρούνται σε εργαζόμενους που εκτίθενται σε θειικό οξύ. Ωστόσο, το επίπεδο έκθεσης, η διάρκεια και ο τύπος επηρεάζουν σημαντικά την έκταση της βλάβης. Το παρακάτω άρθρο διερευνά τις ιδιότητες, τη δομή και τις διάφορες χρήσεις του θειικού οξέος.
H2 SO4 Σύνθετη ονομασία
H2 SO4 έχει έντονη όξινη φύση. Χρησιμεύει ως οξειδωτικός και αφυδατικός παράγοντας σε υψηλότερες συγκεντρώσεις. Παράγει θερμότητα όταν διαλύεται στο νερό. Το οξύ έχει τα ακόλουθα ονόματα:
- Θειικό οξύ
- Θειικό οξύ
- Περισσότερο οξύ
- Λάδι βιτριόλης
- Διυδροθειικό
- Οξύ μπαταρίας
- Οξύ εμβάπτισης
- Ηλεκτρολυτικό οξύ
- Καφέ λάδι βιτριόλης
Δομή του θειικού οξέος
Περιλαμβάνει δύο άτομα υδρογόνου συνδεδεμένα σταθερά με δύο άτομα οξυγόνου, σχηματίζοντας δύο ομάδες ΟΗ. Δύο άτομα οξυγόνου συνδέονται επίσης με το κεντρικό θείο μέσω διπλών δεσμών. Το οξύ είναι ένα ομοιοπολικό μόριο με τετραεδρική δομή.
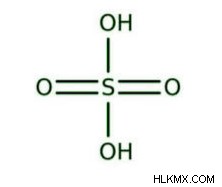
Αυτό το ισχυρό οξύ ιονίζεται πλήρως για να σχηματίσει τα ακόλουθα δύο ιόντα:
- ιόντα υδρονίου (H3 O)
- υδροθειικά ιόντα (HSO)
Δομή θειικού οξέος Lewis
Η δομή Lewis, που δείχνει συνδεδεμένα και μη συνδεδεμένα ζεύγη ηλεκτρονίων, είναι η εξής:
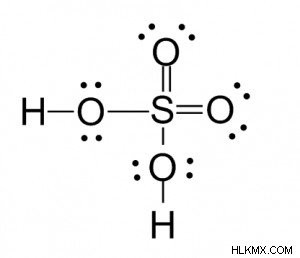
Το θειικό οξύ περιέχει
- Οκτώ μεμονωμένα ζεύγη ηλεκτρονίων ή 16 μη συνδεδεμένα ηλεκτρόνια
- Οκτώ συνδεδεμένα ζεύγη ηλεκτρονίων
Παρασκευή Θειικού Οξέος
Παράγεται με μια διαδικασία επαφής. Τα βασικά βήματα της αντίδρασης συνοψίζονται ως εξής:
Βήμα 1 :Παρασκευή διοξειδίου του θείου
Η καύση θείου σε περίσσεια αέρα με άφθονο οξυγόνο δίνει διοξείδιο του θείου. Η ισορροπημένη αντίδραση είναι η εξής:
S(s) + O2 (ζ) → SO2 (ζ)
Εδώ, το στερεό θείο αντιδρά με το αέριο οξυγόνο για να δώσει αέριο διοξείδιο του θείου.
Βήμα 2:Μετατροπή διοξειδίου του θείου σε τριοξείδιο του θείου
Όταν το διοξείδιο του θείου αντιδρά με το οξυγόνο σε ίση αναλογία, σχηματίζεται τριοξείδιο του θείου. Η θερμοκρασία που απαιτείται για την αντίδραση είναι 400 °C – 450 °C. Επίσης, θα πρέπει να διατηρείται πίεση 1-2 atm. Το πεντοξείδιο του βαναδίου χρησιμεύει ως καταλύτης για την αντίδραση. Η αντίδραση απαιτεί ιδιαίτερη προσοχή επειδή είναι αναστρέψιμη στη φύση της.
2 SO2 (ζ) + O2 (ζ) ⇌ 2 SO3 (ζ)
Βήμα 3:Παρασκευή συμπυκνωμένου θειικού οξέος
Τώρα το τριοξείδιο του θείου αντιδρά με το πυκνό θειικό οξύ, καθώς το αέριο τριοξείδιο του θείου δεν μπορεί να διαλυθεί απευθείας στο νερό, καθώς οδηγεί στο σχηματισμό ομίχλης.
Έτσι, όταν το τριοξείδιο του θείου αντιδρά με το θειικό οξύ, σχηματίζεται ελαίο. Στη συνέχεια, το έλαιο διαλύεται σε νερό για να παραχθεί πυκνό θειικό οξύ.
H2 SO4 + SO3 (ζ) → H2 S2 O7 (l)
H2 S2 O7 (l) + H2 O(l) → 2 H2 SO4
Ιδιότητες του θειικού οξέος
Όπως αναφέρθηκε προηγουμένως, το θειικό οξύ είναι έντονα όξινο και διαβρωτικό. Δρα ως οξειδωτικός και αφυδατικός παράγοντας. Είναι άοσμο και άχρωμο. Είναι υδατοδιαλυτό και πολύ πολικό υγρό. Είναι ένα από τα σημαντικότερα βαρέα βιομηχανικά χημικά με μεγάλης κλίμακας χρήσεις σε διάφορες βιομηχανίες.
Εμφανίζεται ως άχρωμο ελαιώδες υγρό που είναι διαβρωτικό για τα μέταλλα και τους ιστούς. Απανθρακώνει το ξύλο και άλλες οργανικές ύλες κατά την επαφή. Ωστόσο, δεν παίρνει φωτιά εύκολα. Μερικές από τις σημαντικές φυσικές ιδιότητες είναι οι εξής:
- Υγροσκοπικό υγρό
- Χρώμα:Άχρωμο έως σκούρο καφέ
- Οσμή:Άοσμο υγρό
- Συνέπεια:Λιπαρό
- Μοριακό Βάρος:98,08
- Αριθμός δωρητών δεσμών υδρογόνου:2
- Αριθμός αποδεκτών δεσμών υδρογόνου:4
- Σημείο βρασμού:337 °C
- Σημείο τήξης:10,31 °C
- Πυκνότητα:1.841
- Πυκνότητα ατμών:3,4
Χημικές αντιδράσεις που περιλαμβάνουν θειικό οξύ
Το θειικό οξύ αντιδρά με διάφορες ουσίες, δίνοντας διαφοροποιημένα προϊόντα. Μερικές σημαντικές χημικές αντιδράσεις αναφέρονται παρακάτω:
Αντίδραση με μέταλλα κατά τη θέρμανση
Το πυκνό θειικό οξύ είναι ένας ισχυρός οξειδωτικός παράγοντας. Μπορεί να οξειδώσει πολλά μέταλλα, με εξαίρεση τον χρυσό, το ιρίδιο, την πλατίνα, το ρόδιο και το ταντάλιο.
- Το θερμό και συμπυκνωμένο θειικό οξύ αντιδρά με μέταλλα όπως το αλουμίνιο και μπορεί να μειωθεί σε H2S, S και SO2.
8 Al + 15H2SO4 (συμπυκνωμένο)→ 4Al2 (SO4)3 + 12 H2O + 3H2S
- Ο χαλκός αντιδρά με θερμό και πυκνό θειικό οξύ για να δώσει την ακόλουθη αντίδραση:
Cu+ 2H2 SO4 →CuSO4 +SO2 +2H2 O
- Αντιδρά με μέταλλα μέσης δραστικότητας, όπως το χρώμιο, για να δώσει τα ακόλουθα προϊόντα:
2Cr + 4 H2 SO4 (συγκεντρωμένο)→ Cr2( SO4 )3 + 4 H2 O + S
- Με μέταλλα χαμηλής δραστικότητας, το θειικό οξύ δίνει την ακόλουθη αντίδραση:
2Bi + 6H2SO4 (συμπυκνωμένο.)→ Bi2(SO4)3 + 6H2O + 3SO2
- Όταν μέταλλα όπως το αλουμίνιο και ο σίδηρος αντιδρούν με ψυχρό συμπυκνωμένο θειικό οξύ, καλύπτονται με ένα φιλμ οξειδίου και η διαδικασία ονομάζεται παθητικοποίηση.
- Αντίδραση με νερό
Μια εξώθερμη διαδικασία παρατηρείται όταν το H2SO4 αναμιγνύεται με νερό. Η αντίδραση δίνει μεγάλη ποσότητα θερμότητας σε βαθμό που το διάλυμα μπορεί ακόμη και να βράσει.
Επομένως, είναι πάντα καλύτερο να προσθέτετε θειικό οξύ στο νερό παρά νερό στο οξύ για να αποφύγετε οποιονδήποτε κίνδυνο.
Η αντίδραση είναι η εξής:
H2 SO4 + H2 O → H3 O + HSO
Ως παράγοντας αφυδάτωσης
Το οξύ είναι μια ισχυρή αφυδατωτική ουσία. Εξωθεί το νερό από διάφορες ενώσεις και έτσι, χρησιμοποιείται συχνά ως ξηραντικός παράγοντας.
Όταν το συμπυκνωμένο θειικό οξύ αντιδρά με τη ζάχαρη ή τη γλυκόζη, δρα ως αφυδατικός παράγοντας. Αφαιρεί το νερό από τη ζάχαρη και η διαδικασία είναι εξαιρετικά εξώθερμη.
C12 H22 O11 + H2 SO4 → 12C + 11H2 O + (μίγμα οξέος και νερού)
Αντίδραση αραιού θειικού οξέος
Μια δημοφιλής αντίδραση είναι η δράση του θειικού οξέος στον ψευδάργυρο για τη λήψη υδρογόνου. Όταν προσθέτετε κόκκους ψευδαργύρου σε αραιό θειικό οξύ, το αέριο υδρογόνο εξελίσσεται ενώ το μέταλλο διαλύεται. Η ισορροπημένη αντίδραση μπορεί να δοθεί ως εξής:
Zn + H2SO4 → ZnSO4 + H2
Το αραιό θειικό οξύ αντιδρά με μέταλλα στα αριστερά του υδρογόνου στη σειρά αντιδραστικότητας και η αντίδραση εξελίσσεται ως εξής:
Ме + H2SO4 (αραιωμένο) → αλάτι + H2↑
Αντίδραση θειικού οξέος και βαρίου
Για την ποιοτική ανάλυση, το θειικό οξύ και το άλας του αντιδρούν με ιόντα βαρίου.
H2SO4 + BaCl2 → BaSO4 + 2HCl
ZnSO4 + BaCl2 → BaSO4 + ZnCl2
Χρήσεις θειικού οξέος
Το θειικό οξύ χρησιμοποιείται σε πολλές βιομηχανίες. Μερικές από τις πιο δημοφιλείς χρήσεις είναι οι εξής:
- Στην παραγωγή λιπασμάτων
- Στην επεξεργασία των λυμάτων
- Σε μπαταρίες μολύβδου-οξέος
- Χρησιμοποιείται στην κατασκευή λιπασμάτων.
- Χρησιμοποιείται ευρέως στην παραγωγή χάλυβα και σιδήρου.
- Ως καταλύτης στην κατασκευή νάιλον
- Στη διύλιση πετρελαίου
- Για την παραγωγή φωσφορικού οξέος
- Ως καθαριστικό για να απαλλαγείτε από τη σκουριά από σίδηρο και χάλυβα
- Ως ηλεκτρολύτης
- Είναι χρήσιμο για την παρασκευή θειικού αμμωνίου.
- Σε μπαταρίες αποθήκευσης
- Στην παραγωγή άλλων χημικών ουσιών
- Για την κατασκευή εκρηκτικών και κόλλας
- Για τη θεραπεία μετάλλων
- Σε μπαταρίες αυτοκινήτου με μόλυβδο
Κίνδυνοι που σχετίζονται με το θειικό οξύ
Το διαβρωτικό οξύ μπορεί να προκαλέσει σοβαρή βλάβη στο δέρμα και τους ιστούς όταν έρθει σε άμεση επαφή. Επιπλέον, οι ατμοί του θειικού οξέος είναι επίσης επιβλαβείς όταν εισπνέονται.
Οι αντιδράσεις στην έκθεση είναι οι εξής:
- Ερεθίζει και καίει το ανθρώπινο δέρμα.
- Προκαλεί ερεθισμό στα μάτια και μπορεί να οδηγήσει ακόμη και σε τύφλωση.
- Μπορεί να προκαλέσει συσσώρευση υγρού στους πνεύμονες. Η κατάσταση ονομάζεται πνευμονικό οίδημα.
- Η έκθεση σε θειικό οξύ μπορεί επίσης να προκαλέσει πονοκεφάλους, έμετο και ναυτία.
- Διαβρώνει τα δόντια εάν πίνεται κατά λάθος.
- Η επαφή με το δέρμα μπορεί να οδηγήσει σε νέκρωση.
- Είναι εξαιρετικά ερεθιστικό για την ανώτερη αναπνευστική οδό.
- Το θειικό οξύ μπορεί να οδηγήσει σε σοβαρή βλάβη στους πνεύμονες και καταστάσεις έκτακτης ανάγκης.
- Μπορεί να οδηγήσει ακόμη και σε θάνατο.
Μερικά παραδείγματα εργαζομένων που εκτίθενται σε θειικό οξύ περιλαμβάνουν
- Εργαζόμενοι σε εξωτερικούς χώρους που εργάζονται σε περιοχές όπου καίγεται πετρέλαιο ή άνθρακας.
- Μηχανικοί που συμμετέχουν στην ανάπτυξη ή συντήρηση μπαταριών.
- Υδραυλικοί που χρησιμοποιούν καθαριστικά λεκάνης τουαλέτας και μείγμα νερού.
- Αυτοί που εργάζονται σε εκδοτικά καταστήματα, φωτογραφία ή τυπογραφεία.
- Πυροσβέστες
- Χαλυβουργοί εκτεθειμένοι σε ομίχλες θειικού οξέος
Συμπέρασμα
Το θειικό οξύ είναι ένα επιβλαβές αλλά χρήσιμο χημικό με υψηλή αξία στη χημική βιομηχανία. Προκαλεί βλάβη στους ανθρώπους και ως εκ τούτου οι οργανισμοί υγειονομικής περίθαλψης συνιστούν στους εργοδότες να ελέγχουν, να αποτρέπουν ή να μειώνουν την έκθεση των εργαζομένων.
Συχνές ερωτήσεις
1. Πώς εξουδετερώνετε το θειικό οξύ;
Α. Η απλή αντίδραση εξουδετέρωσης λειτουργεί καλύτερα για το θειικό οξύ. Όταν ρίχνετε τη μαγειρική σόδα στη χυμένη οξύτητα, θα εξουδετερώσει το οξύ για να δώσει αλάτι και νερό. Η διαδικασία λειτουργεί με ελαφρά οξέα όπως οξικό και τοξικό, ισχυρά οξέα όπως θειικά οξέα.
2. Το θειικό οξύ είναι ιοντικό;
Α. Το θειικό οξύ είναι μια ομοιοπολική ένωση καθώς περιέχει ομοιοπολικούς δεσμούς. Ωστόσο, ιονίζεται για να δώσει ιόντα υδρονίου και θειικών σε διάλυμα.
3. Είναι δυνατόν να εξουδετερωθεί το θειικό οξύ με νερό;
Α. Όχι, το θειικό οξύ δεν μπορεί να εξουδετερωθεί χρησιμοποιώντας νερό. Ωστόσο, μπορείτε να αραιώσετε το οξύ με νερό. Προσθέστε μερικές σταγόνες οξέος στο νερό προσεκτικά. Το καλύτερο θα ήταν να ανακατέψετε το μείγμα γιατί η διαδικασία είναι εξώθερμη.
Θα χρειαστείτε ισχυρές βάσεις όπως το υδροξείδιο του νατρίου για να εξουδετερώσετε το θειικό οξύ.
4. Σε ποιες αντιδράσεις χρησιμοποιείται το θειικό οξύ ως καταλύτης;
Α. Το θειικό οξύ συμμετέχει άμεσα σε αρκετές αντιδράσεις. Οι ακόλουθες αντιδράσεις χρησιμοποιούν θειικό οξύ ως καταλύτη:
- Η διαδικασία κατασκευής του νάιλον
- Διαδικασία Manheim για την παραγωγή HCl
- Διύλιση πετρελαίου




