Διαφορά μεταξύ Carbocation και Carbanion
Κύρια διαφορά – Carbocation εναντίον Carbanion
Carbocation και carbanion είναι δύο όροι που χρησιμοποιούνται συχνά στην οργανική χημεία. Αυτά είναι οργανικά χημικά είδη που φέρουν ηλεκτρικό φορτίο σε ένα άτομο άνθρακα. Τα καρβοκατιόντα και τα καρβανιόντα βρίσκονται συχνά ως ενδιάμεσα ορισμένων αντιδράσεων. Η κύρια διαφορά μεταξύ του καρβοκατιόντος και του ανθρακιόντος είναι ότι το καρβοκατιόν περιέχει ένα άτομο άνθρακα που φέρει θετικό φορτίο ενώ το καρβοκατιόν περιέχει ένα άτομο άνθρακα που φέρει αρνητικό φορτίο.
Βασικές περιοχές που καλύπτονται
1. Τι είναι το Carbocation
– Ορισμός, τύποι, σχηματισμός, αντιδράσεις με παραδείγματα
2. Τι είναι το Carbanion
– Ορισμός, τύποι, σχηματισμός, αντιδράσεις με παραδείγματα
3. Ποια είναι η διαφορά μεταξύ Carbocation και Carbanion
– Σύγκριση βασικών διαφορών
Βασικοί όροι: Carbocation, Carbanion, Ηλεκτρόφιλη προσθήκη, Ενδιάμεσα, Methyl Carbanion, Methyl Carbocation, Nucleophilic Addition, Primary Carbanion, Primary Carbocation, Secondary Carbanion, Secondary Carbocation, Tritary Carbanion, Tirtiary Carbocation,
Τριγωνικό Επίπεδο, Πυραμιδικό 
Τι είναι το Carbocation
Ο όρος καρβοκατιόν μπορεί να οριστεί ως ένα ιόν που περιέχει ένα θετικά φορτισμένο άτομο άνθρακα. Το καρβοκατιόν αναφέρεται σε ολόκληρο το μόριο, όχι μόνο στο θετικά φορτισμένο άτομο άνθρακα. Ένα καρβοκατιόν μπορεί να έχει ένα ή περισσότερα θετικά φορτία. Αυτά τα καρβοκατιόντα είναι γενικά ασταθή επειδή τα τροχιακά p του ατόμου άνθρακα είναι ελεύθερα λόγω απώλειας ηλεκτρονίων. Επομένως, τα καρβοκατιόντα είναι πολύ συχνά αντιδραστικά. Αυτό ευνοεί την αντίδραση μεταξύ ενός καρβοκατιόντος και ενός πυρηνόφιλου. Τα καρβοκατιόντα είναι παραμαγνητικά λόγω ατελούς ζεύγους ηλεκτρονίων. Τυπικά, τα καρβοκατιόντα παρουσιάζουν υβριδισμό sp. Αυτό συμβαίνει επειδή ένα άτομο άνθρακα με θετικό φορτίο μπορεί να έχει μόνο τρεις δεσμούς γύρω του. Η γεωμετρία γύρω από αυτόν τον άνθρακα είναι τριγωνική επίπεδη.
Γενικά, τα καρβοκατιόντα χωρίζονται σε τέσσερις ομάδες ανάλογα με τον αριθμό των ατόμων άνθρακα στα οποία συνδέεται το θετικά φορτισμένο άτομο άνθρακα.
Τύποι Carbocation
Μεθυλοκαρβοκατιόν
Αυτά τα καρβοκατιόντα περιέχουν ένα θετικά φορτισμένο άτομο άνθρακα που δεν είναι συνδεδεμένο με άλλα άτομα άνθρακα.

Εικόνα 01:Καρβοκατιόν μεθυλίου
Πρωτεύον καρβοκατιόν
Εδώ, το θετικά φορτισμένο άτομο άνθρακα στο καρβοκατιόν συνδέεται με ένα άλλο άτομο άνθρακα μέσω ενός ομοιοπολικού δεσμού. Αυτού του είδους τα καρβοκατιόντα είναι σταθερά από τα καρβοκατιόντα του μεθυλίου αλλά είναι λιγότερο σταθερά από άλλα καρβοκατιόντα.

Εικόνα 02:Πρωτογενές καρβοκατιόν. Εδώ μια ομάδα –HH3 συνδέεται με το θετικά φορτισμένο άτομο άνθρακα.
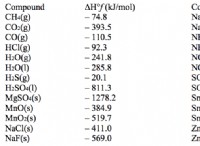
Δευτερογενές καρβοκατιόν
Το θετικά φορτισμένο άτομο άνθρακα συνδέεται με δύο άλλα άτομα άνθρακα. Αυτά τα καρβοκατιόντα είναι σταθερά από τα πρωτογενή καρβοκατιόντα.
Εικόνα 03:Ένα δευτερεύον καρβοκατιόν. Εδώ, το θετικά φορτισμένο άτομο άνθρακα συνδέεται με δύο άλλα άτομα άνθρακα. Αυτά τα δύο άτομα άνθρακα φαίνονται με κόκκινους κύκλους.
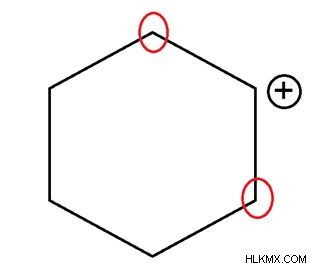
Τριτογενές Carbocation
Το θετικά φορτισμένο άτομο άνθρακα συνδέεται με τρία άλλα άτομα άνθρακα. Αυτή η φόρμα είναι πολύ σταθερή.
Εικόνα 04:Τριτογενές καρβοκατιόν
Σχηματισμός ενανθράκωσης
Διάσπαση του δεσμού μεταξύ μιας ομάδας που αποχωρεί και του ατόμου άνθρακα
Εάν το οργανικό μόριο έχει καλή αποχωρούσα ομάδα, μπορεί να φύγει από το μόριο μέσω ιονισμού. Αυτός ο ιονισμός δίνει το δεσμευτικό ζεύγος ηλεκτρονίων στην αποχωρούσα ομάδα, με αποτέλεσμα ένα θετικό φορτίο στο άτομο άνθρακα.
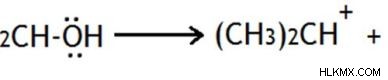
Ηλεκτρόφιλη προσθήκη
Ένα ηλεκτρόφιλο μπορεί να επιτεθεί σε έναν δεσμό pi και να δημιουργήσει ομοιοπολικό δεσμό με ένα από τα άτομα άνθρακα του βινυλίου. Αυτό αναγκάζει το άλλο άτομο άνθρακα βινυλίου να αποκτήσει θετικό φορτίο λόγω της έλλειψης ηλεκτρονίων.

Εικόνα 06:Ηλεκτρόφιλη προσθήκη του "Χ"
Λόγω της υψηλής αντιδραστικότητας των καρβοκατιόντων, υφίστανται χημικές αντιδράσεις πολύ εύκολα.
Αντιδράσεις καρβοκατιόντων
Πυρηνόφιλη προσθήκη
Το πυρηνόφιλο είναι ένα χημικό είδος πλούσιο σε ηλεκτρόνια. Μπορεί να δώσει ηλεκτρόνια στο θετικά φορτισμένο άτομο άνθρακα του καρβοκατιόντος σχηματίζοντας ομοιοπολικό δεσμό με το άτομο άνθρακα.

Εικόνα 07:Τα ζεύγη ηλεκτρονίων του ατόμου οξυγόνου στο H2O μπορούν να δωριστούν σε ένα καρβοκατιόν
Αναδιάταξη
Το καρβοκατιόν μπορεί να αναδιαταχθεί σχηματίζοντας ένα σταθερό καρβοκατιόν διαφορετικό από το υπάρχον καρβοκατιόν, ανταλλάσσοντας τα ηλεκτρόνια σύνδεσης με παρακείμενους δεσμούς.

Εικόνα 08:Αναδιάταξη καρβοκατιόντων
Η παραπάνω εικόνα δείχνει αναδιάταξη ενός καρβοκατιόντος. Εκεί το θετικό φορτίο μετακινείται από το ένα άτομο άνθρακα στο άλλο. Αλλά η νέα δομή είναι σταθερή επειδή είναι ένα δευτερεύον καρβοκατιόν. Το αρχικό ιόν ήταν ένα πρωτογενές καρβοκατιόν.
Τι είναι το Carbanion
Το καρβανιόν είναι ένα ιόν που περιέχει ένα αρνητικά φορτισμένο άτομο άνθρακα. Σε αντίθεση με ένα καρβοκατιόν, ένα άτομο άνθρακα που φέρει το αρνητικό φορτίο είναι sp υβριδοποιημένο και η γεωμετρία είναι πυραμιδική (εκτός από το βενζυλοκαρβανιόν). Τα εξωτερικά τροχιακά του ατόμου άνθρακα υπακούουν στον κανόνα της οκτάδας, έχοντας οκτώ ηλεκτρόνια. Ένα carbanion λειτουργεί σχεδόν πάντα ως πυρηνόφιλο. Επομένως, μπορεί να αντιδράσει με ηλεκτρόφιλα. Τα καρβανιόν είναι διαμαγνητικά λόγω της ολοκλήρωσης του ζεύγους ηλεκτρονίων.
Διάφοροι τύποι καρβανιόν
Methyl Carbanion
Το αρνητικά φορτισμένο άτομο άνθρακα δεν συνδέεται με κανένα άλλο άτομο άνθρακα.
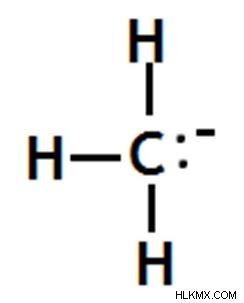
Εικόνα 09:Το Methyl Carbanion
Primary Carbanion
Εδώ το αρνητικά φορτισμένο άτομο άνθρακα στο καρβανιόν συνδέεται με ένα άλλο άτομο άνθρακα μέσω ενός ομοιοπολικού δεσμού.
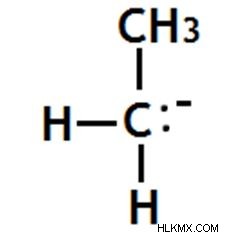
Εικόνα 10:Ένα πρωτεύον Carbanion
Δευτερογενές Carbanion
Το αρνητικά φορτισμένο άτομο άνθρακα συνδέεται με δύο άλλα άτομα άνθρακα.
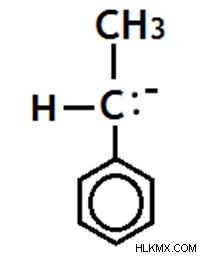
Εικόνα 11:Ένα δευτερεύον καρβανιόν
Τριτογενές Carbanion
Το αρνητικά φορτισμένο άτομο άνθρακα συνδέεται με τρία άλλα άτομα άνθρακα.
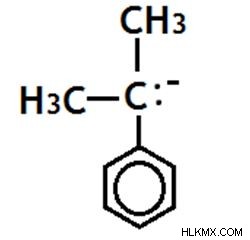
Εικόνα 12:Τριτογενής Καρβανιόν
Ένα καρβανιόν σχηματίζεται όταν μια ομάδα ή ένα άτομο εγκαταλείπει τα συνδετικά ηλεκτρόνια.

Εικόνα 13:Το άτομο Η φεύγει ως πρωτόνιο, δίνοντας το ζεύγος ηλεκτρονίων που συνδέεται με το άτομο άνθρακα
Τα ανθρακώματα υφίστανται κυρίως ηλεκτροφιλικές αντιδράσεις προσθήκης καθώς μπορούν να λειτουργήσουν ως πυρηνόφιλα. Επομένως, αντιδρούν με ηλεκτρόφιλα.
Κύριες αντιδράσεις καρβανιόντων
Αντιδράσεις προσθήκης
Εικόνα 14:Στο βενζυλοκαρβανιόν, το αρνητικά φορτισμένο άτομο άνθρακα είναι υβριδισμένο sp2 και έχει επίπεδη γεωμετρία. (πρόκειται για εξαίρεση όπως αναφέρθηκε παραπάνω)
Αναδιάταξη

Εικόνα 15:Οι δομές συντονισμού των Carbanions
Η δομή των καρβανιόντων μπορεί να αλλάξει προκειμένου να επιτευχθεί η πιο σταθερή δομή. Εκεί μπορούν να μετακινηθούν τα δεσμευτικά ζεύγη ηλεκτρονίων. Αυτό προκαλεί το carbanion να γίνει ένα κανονικό ιόν, όχι ένα carbanion.
Διαφορά μεταξύ Carbocation και Carbanion
Ορισμός
Carbocation: Το καρβοκατιόν είναι ένα ιόν που περιέχει ένα θετικά φορτισμένο άτομο άνθρακα.
Carbanion: Το καρβανιόν είναι ένα ιόν που περιέχει αρνητικό φορτισμένο άτομο άνθρακα.
Υβριδισμός
Carbocation: Το άτομο άνθρακα που φέρει το θετικό φορτίο υβριδίζεται sp σε Carbocation.
Carbanion: Το άτομο άνθρακα που φέρει το αρνητικό φορτίο υβριδίζεται sp σε Carbanion.
Γεωμετρία
Carbocation: Η γεωμετρία του ατόμου άνθρακα είναι τριγωνική επίπεδη στο Carbocation.
Carbanion: Η γεωμετρία του ατόμου άνθρακα είναι πυραμιδική στο Carbanion.
Μαγνητικές ιδιότητες
Carbocation: Το καρβοκατιόν είναι παραμαγνητικό.
Carbanion: Το Carbanion είναι διαμαγνητικό.
Αντιδράσεις
Carbocation: Το καρβοκατιόν ενεργεί ως ηλεκτρόφιλο σε χημικές αντιδράσεις.
Carbanion: Το Carbanion δρα ως πυρηνόφιλο σε χημικές αντιδράσεις.
Συμπέρασμα
Το καρβοκατιόν και το καρβανιόν αναφέρονται σε οργανικά χημικά είδη που φέρουν ηλεκτρικό φορτίο σε ένα άτομο άνθρακα. Η κύρια διαφορά μεταξύ του καρβοκατιόντος και του ανθρακιόντος είναι ότι το καρβοκατιόν περιέχει ένα άτομο άνθρακα που φέρει θετικό φορτίο ενώ το ανθρακικό περιέχει ένα άτομο άνθρακα που φέρει αρνητικό φορτίο.