Τι είναι η Ηλεκτροχημεία;
Βασικές έννοιες
Σε αυτό το σεμινάριο, θα μάθετε τα βασικά της ηλεκτροχημείας, συμπεριλαμβανομένης της οξείδωσης, της αναγωγής, των γαλβανικών στοιχείων και των εφαρμογών της ηλεκτροχημείας. Θα εξετάσουμε επίσης τις θεμελιώδεις εξισώσεις ηλεκτροχημείας και τον τρόπο χρήσης τους.
Η Ηλεκτροχημεία είναι το πεδίο που μελετά τον τρόπο με τον οποίο οι χημικές αντιδράσεις σχετίζονται με τον ηλεκτρισμό. Αυτό περιλαμβάνει χημικές αντιδράσεις που παράγουν ηλεκτρισμό όπως στις μπαταρίες, χημικές αντιδράσεις που απαιτούν ηλεκτρισμό και πολλά άλλα.
Θέματα που καλύπτονται σε άλλα άρθρα
- Ηλεκτροχημικά κύτταρα
- Κατανόηση των αντιδράσεων οξειδοαναγωγής
- Πώς να εξισορροπήσετε τις αντιδράσεις οξειδοαναγωγής
- Τι είναι η σταθερά ισορροπίας;
- Πώς να γράψετε καθαρές ιοντικές εξισώσεις
Λεξιλόγιο
Οξείδωση :η διαδικασία ενός ατόμου που χάνει ένα ηλεκτρόνιο
Μείωση :η διαδικασία ενός ατόμου που κερδίζει ένα ηλεκτρόνιο
Αντίδραση οξειδοαναγωγής :μια χημική αντίδραση όπου συμβαίνει οξείδωση και αναγωγή, που σημαίνει ότι τα ηλεκτρόνια μεταφέρονται μεταξύ χημικών ειδών
Κουλόν :η μονάδα SI για ηλεκτρικό φορτίο (συντομογραφία C)
Τάση (γνωστός και ως Δυνατότητα ):η ενέργεια που μεταφέρεται από το ηλεκτρικό φορτίο (μονάδες Joule/Coulomb)
Αντιδράσεις οξειδοαναγωγής
Οι περισσότερες χημικές αντιδράσεις είναι πολύ απλές από την οπτική γωνία ενός ηλεκτρονίου. Οι δεσμοί μπορεί να σχηματιστούν ή να σπάσουν, αλλά γενικά, κάθε άτομο θα διατηρήσει τα ηλεκτρόνια του ανέπαφα. Αυτό δεν ισχύει για τις οξειδοαναγωγικές αντιδράσεις. Το "οξειδοαναγωγή" προέρχεται από τον συνδυασμό "αναγωγής" και "οξείδωσης". Μια αντίδραση οξειδοαναγωγής είναι αυτή όπου τα ηλεκτρόνια χάνονται από άτομα ή μόρια και μεταφέρονται σε άλλα. Αυτή η μεταφορά ηλεκτρονίων είναι ο πυρήνας της ηλεκτροχημείας. Για περισσότερες πληροφορίες σχετικά με τις αντιδράσεις οξειδοαναγωγής και τον τρόπο εξισορρόπησής τους, ανατρέξτε στους συνδεδεμένους οδηγούς μας.
Παραδείγματα αντιδράσεων οξειδοαναγωγής
2Na (s) + 2H2 O (l) → 2NaOH (υδατ.) + H2 (ζ)
Fe (aq) + Ag (aq) → Fe (aq) + Ag (s)
2Al (s) + 6H (aq) → 2Al (aq) + 3H2 (ζ)
Ημιαντιδράσεις
Όταν μια αντίδραση οξειδοαναγωγής χωρίζεται στις ημιαντιδράσεις αναγωγής και οξείδωσης, τα ηλεκτρόνια γράφονται ως προϊόντα και ως αντιδρώντα, αντίστοιχα. Ονομάζονται ημι-αντιδράσεις γιατί όταν «προστεθούν» μαζί, δημιουργούν τη συνολική αντίδραση οξειδοαναγωγής. Οι μισές αντιδράσεις μπορούν συχνά να εξεταστούν ανεξάρτητα.
Γαλβανικά κύτταρα
Ένα γαλβανικό στοιχείο είναι μια εγκατάσταση που διευκολύνει τις αντιδράσεις οξειδοαναγωγής με ελεγχόμενο και συγκεκριμένο τρόπο που παράγει ρεύμα (ροή ηλεκτρονίων). Το βολταϊκό στοιχείο, το ηλεκτροχημικό στοιχείο και η μπαταρία είναι όλα διαφορετικά ονόματα για ένα γαλβανικό στοιχείο. Δείτε το αναλυτικό μας σεμινάριο για τα γαλβανικά κύτταρα εδώ.
Διάγραμμα βολταϊκών στοιχείων
Παρακάτω είναι ένα διάγραμμα που δείχνει ένα τυπικό βολταϊκό στοιχείο.
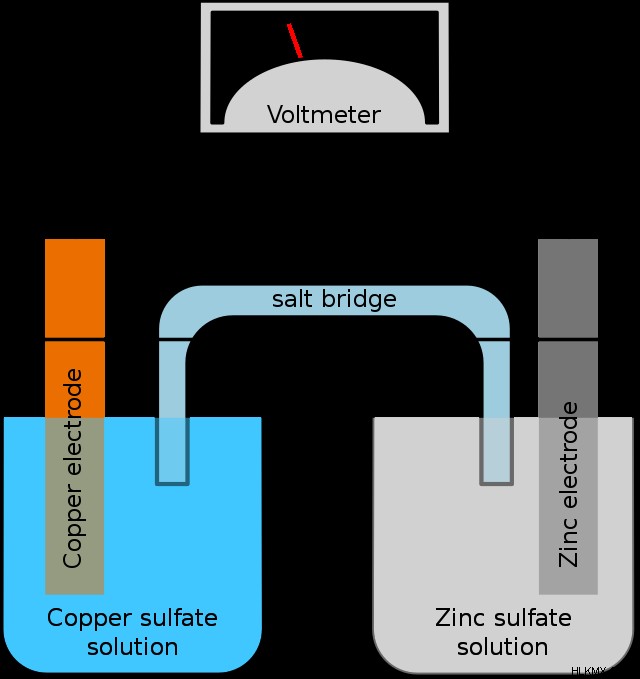
Ας αναλύσουμε το διάγραμμα και ας δούμε κάθε μέρος του κελιού.
Πρώτον, η «χάλκινη πλευρά» του κυττάρου, που ονομάζεται μειωτικό μισό κύτταρο . Ονομάζεται αυτό επειδή περιλαμβάνει το ήμισυ του συνολικού βολταϊκού κυττάρου και εκεί ρέουν τα ηλεκτρόνια (που σημαίνει ότι η μείωση συμβαίνει εκεί). Τα εισερχόμενα ηλεκτρόνια μειώνουν τα ιόντα χαλκού στο διάλυμα σχηματίζοντας χαλκόμεταλλο, το οποίο εναποτίθεται στην επιφάνεια του ηλεκτροδίου χαλκού.
Στη συνέχεια, η «πλευρά ψευδάργυρου» του κυττάρου ονομάζεται ημικύτταρο οξείδωσης . Ονομάζεται αυτό επειδή ο ψευδάργυρος εγκαταλείπει τα ηλεκτρόνια του (οξείδωση). Καθώς τα ηλεκτρόνια αποχωρούν από το μέταλλο ψευδάργυρου στο ηλεκτρόδιο, ρέουν πάνω από το σύρμα στο ημικύτταρο αναγωγής και τα ιόντα ψευδαργύρου που έχουν απομείνει εισέρχονται στο διάλυμα.
Το σύρμα που συνδέει τα δύο ημικύτταρα είναι αυτό που επιτρέπει στα ηλεκτρόνια να ρέουν. Χωρίς το καλώδιο, αυτή η ρύθμιση δεν κάνει τίποτα, γιατί δεν υπάρχει τίποτα που να επιτρέπει την πρόοδο της ηλεκτροχημικής αντίδρασης. Το καλώδιο γενικά περιλαμβάνει ένα βολτόμετρο, μια συσκευή που μετρά την τάση του στοιχείου.
Τέλος, η αλατογέφυρα, ο αφανής ήρωας του γαλβανικού κυττάρου. Περιέχει άλατα ιόντων θεατών που εξισορροπούν τη συσσώρευση φορτίου που σχηματίζεται καθώς προχωρά η αντίδραση. Τα θετικά φορτισμένα ιόντα ψευδαργύρου σχηματίζονται σε ένα κύτταρο και τα θετικά φορτισμένα ιόντα χαλκού αφήνουν το άλλο καθώς ρέουν τα ηλεκτρόνια. Το μη ισορροπημένο ηλεκτρικό φορτίο είναι εξαιρετικά δυσμενείς στη χημεία, και ως εκ τούτου η αντίδραση δεν μπορεί να προχωρήσει χωρίς κάτι που να εξισορροπεί το φορτίο. Η γέφυρα αλατιού κάνει ακριβώς αυτό, παρέχοντας θετικά ιόντα στο ημικύτταρο αναγωγής και αρνητικά ιόντα στο μισό κύτταρο οξείδωσης. Χωρίς γέφυρα αλατιού, τα γαλβανικά στοιχεία δεν λειτουργούν.
Αυθορμητισμός και ισορροπία
Μπορεί να θυμάστε από τη θερμοδυναμική ότι ορισμένες διεργασίες είναι αυθόρμητες ή συμβαίνουν χωρίς την εισαγωγή ενέργειας. Το ∆G («δέλτα-G»), η αλλαγή στην ελεύθερη ενέργεια Gibbs του συστήματος, αντιπροσωπεύει τον αυθορμητισμό. Όταν το ΔG είναι αρνητικό, η ενέργεια του συστήματος έχει μειωθεί (ευνοηθεί). Όταν το ∆G είναι θετικό, η ενέργεια του συστήματος έχει ανέβει (μη ευνοϊκή).
Οι ηλεκτροχημικοί χρησιμοποιούν λιγότερο το ΔG, επειδή η τάση ενός οξειδοαναγωγικού συστήματος αντιπροσωπεύει το ίδιο πράγμα - ευνοϊκότητα. Όταν η τάση μιας αντίδρασης είναι ΘΕΤΙΚΗ, η αντίδραση ευνοεί την προς τα εμπρός κατεύθυνση και θα συμβεί αυθόρμητα. Όταν η τάση είναι ΑΡΝΗΤΙΚΗ, η αντίδραση δεν ευνοεί την κατεύθυνση προς τα εμπρός και ΔΕΝ θα συμβεί αυθόρμητα. Αυτό μπορεί να είναι λίγο μπερδεμένο επειδή τα σημάδια είναι διαφορετικά μεταξύ τάσης και ΔG. Ωστόσο, μπορεί να είναι εύκολο να το θυμάστε αν κοιτάξετε έναν πίνακα μείωσης. Όλα τα αλκαλικά μέταλλα και άλλα εύκολα οξειδωμένα μέταλλα όπως ο ψευδάργυρος και ο σίδηρος ευνοούνται περισσότερο να χάσουν ηλεκτρόνια παρά να τα αποκτήσουν. Το αντίστροφο ισχύει για τα αμέταλλα όπως το φθόριο και διάφορα μέταλλα όπως ο χαλκός και το ασήμι που είναι δύσκολο να οξειδωθούν – αυτά τα στοιχεία ευνοούν την απόκτηση ηλεκτρονίων.
Εξισώσεις Ηλεκτροχημείας
Θερμοδυναμικές μετατροπές
Eκελί , η τάση, μπορεί να συσχετιστεί μαθηματικά με την αλλαγή ελεύθερης ενέργειας ΔG και τη σταθερά ισορροπίας Keq . Οι παρακάτω εξισώσεις συσχετίζουν αυτές τις τρεις ποσότητες:
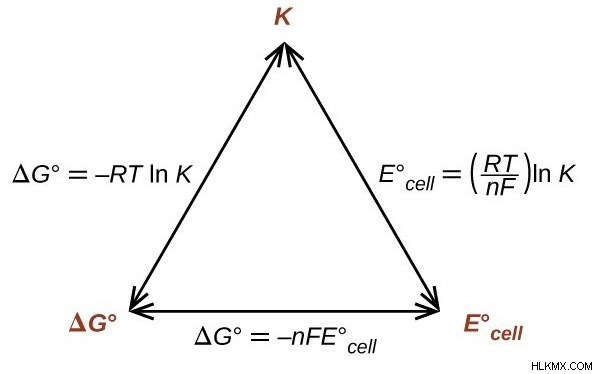
R:η σταθερά αερίου (σε θερμοδυναμική μορφή), ίση με 8,314 J/mol*K.
T:η θερμοκρασία σε Kelvin.
n:ο αριθμός των ηλεκτρονίων που μεταφέρθηκαν στην αντίδραση.
F:Η σταθερά του Faraday, ίση με 96485 C/mol ηλεκτρονίων.
Δυνατότητα κελιού
Eκελί =Eκόκκινο + Eox =Εκάθοδος – Εάνοδος
Για την παραπάνω εξίσωση καθόδου/ανόδου, χρησιμοποιήστε την αναγωγή δυνατότητες και για τα δύο. Αυτό σημαίνει ότι το δυναμικό στην άνοδο μπορεί να είναι αρνητικό. Για την εξίσωση red/ox, χρησιμοποιήστε το δυναμικό αναγωγής για την κάθοδο και την αντίθετη τιμή για την άνοδο (το δυναμικό οξείδωσης).
Η εξίσωση Nernst
Υπάρχει μια ακόμη εξίσωση που χρησιμοποιείται συχνά στην ηλεκτροχημεία, και αυτή είναι η εξίσωση Nernst. Μέχρι αυτό το σημείο, υποθέταμε ότι οι συγκεντρώσεις των ιόντων στο διάλυμα δεν αλλάζουν. Με άλλα λόγια, έχουμε να κάνουμε με το αρχικό δυναμικό του κυττάρου μόνο σε τυπικές συνθήκες. Ωστόσο, τα μειωμένα ιόντα και/ή η άνοδος στις πραγματικές μπαταρίες τελειώνουν τελικά. Αυτό συμβαίνει όταν μια μπαταρία πεθαίνει - δεν υπάρχουν αρκετά κατιόντα που παραμένουν στο διάλυμα καθόδου ή/και πάρα πολλά κατιόντα στο διάλυμα ανόδου για να προχωρήσει η αντίδραση. Η εξίσωση Nernst ασχολείται με συνθήκες μη ισορροπίας όπως αυτές. Για μια εις βάθος εξήγηση σχετικά με τη χρήση της εξίσωσης Nernst, ανατρέξτε σε αυτό το άρθρο.
Ηλεκτρόλυση
Η ηλεκτρόλυση είναι η διαδικασία χρήσης ηλεκτρικού ρεύματος για να «αναγκάσει» να συμβεί μια αντίδραση που διαφορετικά δεν θα γινόταν. Αυτή η τεχνική χρησιμοποιείται συχνά για την αποσύνθεση ενώσεων. Ένα παράδειγμα είναι η αντίδραση 2H2 O → 2Η2 + O2 που παράγει υδρογόνο και αέριο οξυγόνο, δύο πολύ χρήσιμα μόρια, από το νερό. Αυτή η αποσύνθεση δεν συμβαίνει φυσικά, αλλά προχωρά εύκολα με μια σχετικά μικρή τάση που εφαρμόζεται. Η ηλεκτρόλυση έχει ευρεία βιομηχανική χρήση για τη λήψη διαφόρων μορίων από μεταλλεύματα, θαλασσινό νερό και άλλες κοινές ουσίες. Για περισσότερες πληροφορίες σχετικά με την ηλεκτρόλυση και τη ρύθμιση των ηλεκτρολυτικών στοιχείων, ανατρέξτε στον οδηγό μας.
Ηλεκτρομετάλλευση
Σε ένα κανονικό γαλβανικό στοιχείο, το κατιόν στο ημικύτταρο αναγωγής ταιριάζει με την κάθοδο. Αυτό συμβαίνει επειδή αυτά τα κατιόντα εναποτίθενται στην επιφάνεια ως μέταλλο. Το κατιόν ταιριάζει με την κάθοδο για να διατηρούνται τα πράγματα καθαρά. Ωστόσο, η αντίδραση μπορεί να προχωρήσει μια χαρά εάν το κατιόν δεν ταιριάζει. Το μεταλλικό κατιόν θα μετατραπεί στην ουδέτερη μεταλλική του μορφή και θα αποτεθεί στην επιφάνεια της καθόδου. Αυτό ονομάζεται ηλεκτρολυτική επιμετάλλωση. Αυτή η διαδικασία προστατεύει τα μέταλλα κάτω από ένα στρώμα άλλου, πιο ελαστικού μετάλλου. Για παράδειγμα, ένα στρώμα χαλκού εμποδίζει τη σκουριά από μέταλλα που οξειδώνονται εύκολα, όπως ο σίδηρος. Η ηλεκτρολυτική επίστρωση είναι εξαιρετικά συνηθισμένη και μια πολύ χρήσιμη τεχνική για την επένδυση μετάλλου με άλλο μέταλλο, η οποία είναι πολύ χρήσιμη σε πολλές εφαρμογές.
Περαιτέρω ανάγνωση
- Ηλεκτροχημικά κύτταρα
- KSP – Σταθερά προϊόντος διαλυτότητας
- Περιοδικές τάσεις
- Διαδραστικός περιοδικός πίνακας




