Τι είναι μια Ομάδα Αποχώρησης;
Βασικές έννοιες
Σε αυτό το σεμινάριο, θα μάθετε τι είναι αποχωρώντας από την ομάδα είναι, καθώς και πώς να αναγνωρίσετε ένα καλό. Επιπλέον, θα μάθετε μια λίστα με παραδείγματα αποχωρήσεων ομάδων που μπορεί να δείτε σε διαφορετικές αντιδράσεις οργανικής χημείας.
Θέματα που καλύπτονται σε άλλα άρθρα
- Πυρηνόφιλα
- Ηλεκτρόφιλα
- Κατιόντα και ανιόντα
- Ιδιότητες οξέος και βάσεων
- Τι είναι το pKa
- Συντονισμός
- Αντιδράσεις συμπύκνωσης
Λεξιλόγιο
- Anion- ένα αρνητικά φορτισμένο ιόν
- Βασικότητα- πώς ένα μόριο λειτουργεί ως βάση
- Κατιόν- ένα θετικά φορτισμένο ιόν
- Συζευγμένη βάση- μόριο που σχηματίζεται όταν ένα οξύ χάνει το όξινο υδρογόνο του
- Συντονισμός- ηλεκτρόνια που κινούνται σε γειτονικά σημεία ενός μορίου για να δημιουργήσουν διαφορετικές θέσεις φορτίου
Αποχώρηση από τον ορισμό της ομάδας
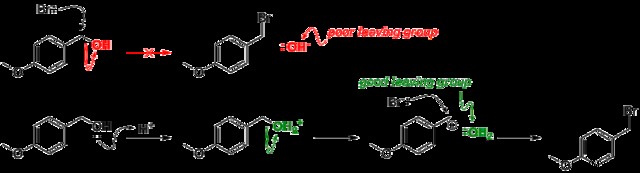
Μια αποχωρούσα ομάδα είναι ένα άτομο ή μια ομάδα ατόμων που μπορούν να απομακρυνθούν από ένα μόριο με ένα μοναχικό ζεύγος, σπάζοντας τον δεσμό μεταξύ αυτού και του μορίου. Λειτουργεί ως το αντίθετο ενός πυρηνόφιλου. αντί να δωρίσει ηλεκτρόνια για να σχηματίσει έναν ομοιοπολικό δεσμό, σπάει αυτόν τον δεσμό και παίρνει τα ηλεκτρόνια καθώς φεύγει. Εξαιτίας αυτού, στο κύριο μόριο συνήθως λείπουν ηλεκτρόνια και μετατρέπεται σε κατιόν.
Οι αποχωρούσες ομάδες είναι συνήθως ανιόντα ή ουδέτερα, αλλά μπορεί να είναι και κατιόντα.
Τι κάνει μια καλή ομάδα που αποχωρεί;
Όσο πιο σταθερό μπορεί να είναι ένα άτομο ή μια ομάδα ατόμων από μόνο του, τόσο καλύτερη είναι μια αποχωρούσα ομάδα.
Αδύναμη βάση
Μια καλή αποχωρούσα ομάδα είναι η συζευγμένη βάση ενός ισχυρού οξέος, μιας ασθενούς βάσης. Όσο πιο σταθερή είναι η συζευγμένη βάση με το μοναχικό ζεύγος, τόσο πιο αδύναμη θα είναι η βάση. Το pKa μπορεί να χρησιμοποιηθεί ως μέτρηση της σταθερότητας ενός μοναχικού ζεύγους ηλεκτρονίων. Όσο χαμηλότερο είναι το pKa, τόσο ισχυρότερο είναι το οξύ και τόσο πιο αδύναμη η συζευγμένη βάση. Διαβάστε περισσότερα εδώ.
Μέγεθος έναντι βασικότητας
Καθώς κινούμαστε προς τα κάτω και προς τα δεξιά του περιοδικού πίνακα, το μέγεθος αυξάνεται. Το μέγεθος και η βασικότητα έχουν αντίστροφη σχέση, που σημαίνει ότι όσο αυξάνεται το μέγεθος, η βασικότητα μειώνεται. Επομένως, όσο μεγαλύτερο είναι το μέγεθος της αποχωρούσας ομάδας, τόσο πιο αδύναμη είναι ως βάση και τόσο πιο πιθανό είναι να απομακρυνθεί από το μόριο.
Συντονισμός
Ο συντονισμός παίζει μεγάλο ρόλο στη σταθερότητα ενός μορίου. είναι όταν τα φορτία μπορούν να μετατοπιστούν ή να εξουδετερωθούν με την κίνηση των ηλεκτρονίων μέσα στο μόριο. Οι αδύναμες βάσεις έχουν συνήθως δομές συντονισμού που είναι αρκετά σταθερές ώστε να στέκονται μόνες τους. Έτσι, εάν μια αποχωρούσα ομάδα μπορεί να σταθεροποιηθεί με συντονισμό, είναι πιο πιθανό να απομακρυνθεί εύκολα από το κύριο μόριο.
Αποχώρηση από Παραδείγματα Ομάδας
- Halides- Br, I, Cl
- Σουλφονικά- OTs, OMs
- Αμμωνία- NH3
- Νερό- H2 O
Περαιτέρω ανάγνωση
- Αντιδράσεις E1
- Αντιδράσεις E2
- Αντιδράσεις Sn1
- Αντιδράσεις Sn2




