Προσέγγιση σταθερής κατάστασης
Βασικές έννοιες
Σε αυτό το άρθρο, θα μάθετε για την προσέγγιση σταθερής κατάστασης, ένα σημαντικό εργαλείο για την κατανόηση της κινητικής των διαδοχικών αντιδράσεων.
Κινητική διαδοχικής αντίδρασης χωρίς την προσέγγιση σταθερής κατάστασης
Η προσέγγιση σταθερής κατάστασης είναι ένα χρήσιμο εργαλείο για την απλοποίηση της μαθηματικής μοντελοποίησης ενός μηχανισμού διαδοχικής αντίδρασης. Στη χημική κινητική, οι διαδοχικές αντιδράσεις μπορεί να φαίνεται να έχουν ξεκάθαρη κινητική, αλλά συχνά περιλαμβάνουν κάποια μαθηματικά που προκαλούν πονοκέφαλο. Κάντε την ακόλουθη διαδοχική αντίδραση:
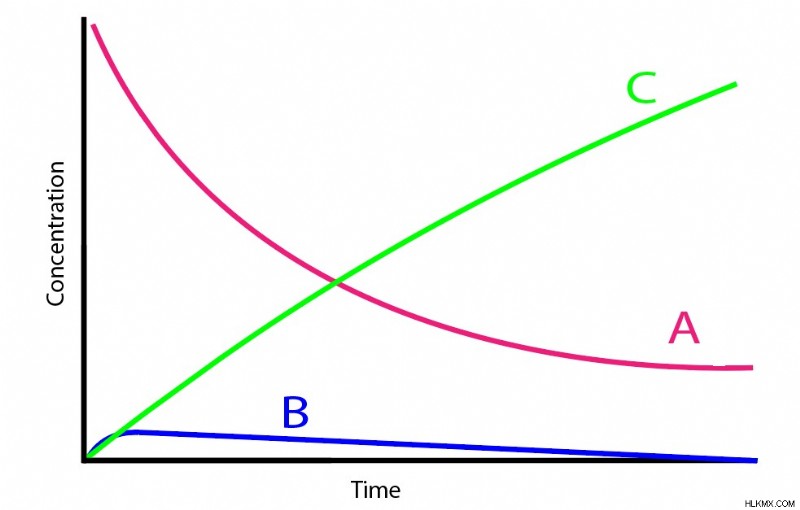
A→B→C
Το μόριο Α μετατρέπεται σε Β, το οποίο με τη σειρά του μετατρέπεται σε C. Σταθερές ρυθμού ka και kb ενημερώνει τους ρυθμούς της πρώτης και της δεύτερης αντίδρασης, αντίστοιχα. Δεδομένου ότι κάθε αντίδραση είναι μονομοριακή, μπορούμε εύκολα να βρούμε τους ρυθμούς μεταβολής κάθε είδους στην αντίδραση:
-ka [A] =(d[A])/t
ka [A]-kb [B] =(d[B])/t
(d[C])/t =kb [B]
Χρησιμοποιώντας τον νόμο του ρυθμού πρώτης τάξης, μπορούμε επίσης να βρούμε την εξίσωση που μοντελοποιεί τη συγκέντρωση του Α με την πάροδο του χρόνου:
[A] =[A]0 e
Στη συνέχεια, μπορούμε να αντικαταστήσουμε αυτόν τον νόμο του ποσοστού με το ρυθμό μεταβολής μας στο B:
(d[B])/t+kb [B] =ka [A]0 e
Μπορούμε να λύσουμε αυτή τη διαφορική εξίσωση αν υποθέσουμε ότι δεν υπήρχε αρχική συγκέντρωση του Β ([B]0 =0) και ότι ka ≠ kb :
[B] =(e-e)ka /(ka -kb )
Τέλος, αν υποθέσουμε επίσης ότι δεν υπήρχε αρχική συγκέντρωση C ([C]0 =0, [A] + [B] + [C] =[A]0 ), τότε λαμβάνουμε μια εξίσωση για τη συγκέντρωση του C με την πάροδο του χρόνου:
[C] =[A]0 (1+(ka e-kb ε)/(κβ -ka ))
Όπως μπορείτε να δείτε, χρησιμοποιώντας αρκετά απλές έννοιες κινητικής πρώτης τάξης, τα μαθηματικά για διαδοχικές αντιδράσεις περιπλέκονται γρήγορα. Όταν εξετάζετε αντιδράσεις με περισσότερα από δύο βήματα, τα μαθηματικά γίνονται μη διαχειρίσιμα. Εδώ αποδεικνύεται χρήσιμη η προσέγγιση σταθερής κατάστασης.
Προσέγγιση σταθερής κατάστασης για μονομοριακή κινητική
Η προσέγγιση της σταθερής κατάστασης υποστηρίζει ότι η αλλαγή στη συγκέντρωση του μορίου Β, της ενδιάμεσης ένωσης, παραμένει πάντα πολύ χαμηλή, αν όχι αμελητέα, σε οποιαδήποτε χρονική στιγμή.
(d[B])/t ≈ 0
Για να γίνει αυτή η προσέγγιση , το σύστημα διαδοχικών αντιδράσεων πρέπει να πληροί δύο συχνά αληθή κριτήρια:
- Η συγκέντρωση του Β παραμένει γενικά πολύ χαμηλότερη σε σχέση με το Α ή το C.
- Ο ρυθμός του Α που αντιδρά στη μορφή Β είναι πολύ πιο αργός από εκείνον του Β που αντιδρά στον σχηματισμό Γ. Αυτό σημαίνει ότι ο σχηματισμός Β είναι το βήμα καθορισμού του ρυθμού.
Πολλά διαδοχικά συστήματα αντίδρασης πληρούν αυτά τα κριτήρια. Συχνά, το Β συμπεριφέρεται ως ασταθές ενδιάμεσο, με αποτέλεσμα να αυξάνεται αρχικά η συγκέντρωσή του μέχρι να φτάσει σε ένα συγκεκριμένο χαμηλό όριο. Στη συνέχεια, οποιοδήποτε επιπλέον Β που παράγεται μετατρέπεται γρήγορα σε C πολύ πιο γρήγορα από την παραγωγή του Β λόγω της αστάθειάς του. Μαθηματικά, αυτό σημαίνει ότι το kb αντιπροσωπεύει πολύ υψηλότερη ποσότητα από το ka.
Με τα δύο κριτήρια που πληρούνται, η προσέγγιση σταθερής κατάστασης απλοποιεί δραστικά τα μαθηματικά. Δηλαδή, μας δίνει έναν τρόπο να συσχετίσουμε άμεσα τις συγκεντρώσεις του Α και του Β:
0 =(d[B])/t =ka [A] – kb [B]
(ka /kb )[A] =[B]
Αυτό μας επιτρέπει να φτάσουμε πιο εύκολα σε μια έκφραση για τη συγκέντρωση του C ως συνάρτηση του χρόνου:
[A]0 =[A] + [B] + [C]
[C] =[A]0 – [A] – [B]
[C] =[A]0 – [A] – (ka /kb )[A]
Στη συνέχεια, εφαρμόζουμε τον νόμο του ποσοστού πρώτης τάξης που σχετίζεται με την αλλαγή στο A για να εκφράσουμε τελικά το C σε όρους χρόνου:
[C] =[A]0 – ([A]0 ε) – ((ka /kb )[A]0 ε)
[C] =[A]0 (1 – e – (ka /kb )ε)
Συχνά, μπορούμε να απλοποιήσουμε περαιτέρω την εξίσωση, εάν ka είναι αμελητέα σε σύγκριση με το kb (ka /kb ≈ 0). Αυτό μας επιτρέπει να παραμελούμε τον τρίτο όρο στην παρένθεση, αποδίδοντας:
[C] =[A]0 (1 – e)
Προσέγγιση σταθερής κατάστασης για ενζυμική κινητική
Εκτός από τη μονομοριακή κινητική, η προσέγγιση της σταθερής κατάστασης αποδεικνύεται χρήσιμη σε πιο περίπλοκες διαδοχικές αντιδράσεις. Η πιο σημαντική εφαρμογή της προσέγγισης σε μη μονομοριακές αντιδράσεις περιλαμβάνει την κινητική Michaelis-Menten της ενζυμικής κατάλυσης. Σε μια γενική αντίδραση που καταλύεται από ένζυμο, το υπόστρωμα (S) συνδέεται αναστρέψιμα με το ένζυμο (Ε), σχηματίζοντας το σύμπλοκο ενζύμου-υποστρώματος (ES). Στη συνέχεια, το ένζυμο καταλύει το σχηματισμό του προϊόντος (P), απελευθερώνοντας από το σύμπλοκο:
E + S ⇌ ES → E + P
Σε αντίθεση με τη μονομοριακή αντίδραση νωρίτερα, αυτή η αντίδραση περιλαμβάνει τρεις συνολικές σταθερές ταχύτητας. k1 περιγράφει τον ρυθμό προώθησης του ενζύμου και του υποστρώματος που σχηματίζει το σύμπλοκο, ενώ k-1 περιγράφει την αντίστροφη αντίδραση. k2 σχετίζεται με το σχηματισμό του προϊόντος και την αναγέννηση του ενζύμου από το σύμπλοκο. Για να απλοποιήσουμε τα μαθηματικά, μπορούμε συχνά να εφαρμόσουμε την προσέγγιση σταθερής κατάστασης καθώς και μια άλλη χρήσιμη προσέγγιση που σχετίζεται με την ισορροπία.
Πώς ταιριάζει η σταθερή κατάσταση με τα ένζυμα
Τόσο σε βιολογικά συστήματα όσο και σε βιομηχανικές εφαρμογές, το υπόστρωμα τείνει να υπάρχει σε τεράστια περίσσεια του ενζύμου. Αυτό πληροί την συνθήκη «χαμηλής συγκέντρωσης ενδιάμεσου» αφού η χαμηλή συγκέντρωση ενζύμου περιορίζει τον σχηματισμό του συμπλόκου. Αυτό από μόνο του μας επιτρέπει να υποθέσουμε μια σταθερή κατάσταση του συμπλέγματος ενζύμων αφού η υψηλή συγκέντρωση του υποστρώματος απαιτεί ουσιαστικά όλα τα ένζυμα να είναι κορεσμένα με υπόστρωμα. Αυτό έχει ως αποτέλεσμα η συγκέντρωση του συμπλέγματος ενζύμου-υποστρώματος να παραμένει σταθερή κατά τη διάρκεια της αντίδρασης:
(d[ES])/t =0
Τα Απλοποιημένα Μαθηματικά
Για να εκφράσουμε τη μεταβολή της συγκέντρωσης του συμπλόκου, χρησιμοποιούμε τον προς τα εμπρός ρυθμό της πρώτης αντίδρασης μείον τον αντίστροφο ρυθμό καθώς και τον ρυθμό εμπρός της δεύτερης αντίδρασης. Είναι σημαντικό ότι μπορούμε να εξαγάγουμε καθένα από αυτά τα ποσοστά χρησιμοποιώντας νόμους συντελεστών πρώτης και δεύτερης τάξης. Στη συνέχεια, μπορούμε να χρησιμοποιήσουμε την προσέγγιση σταθερής κατάστασης για να συσχετίσουμε τους τρεις ρυθμούς:
(d[ES])/t =0 =k1 [E][S] – k-1 [ES] – k2 [ES]
k1 [E][S] =k-1 [ES] + k2 [ES]
Μπορούμε στη συνέχεια να αναδιατάξουμε για να προκύψει η ακόλουθη εξίσωση:
([E][S])/([ES]) =(k-1 + k2 )/k1
Σε αυτό το σημείο, θα πρέπει να θυμόμαστε ότι το [E] και το [ES] σχετίζονται μαθηματικά το ένα με το άλλο. Συγκεκριμένα, η προσθήκη τους αποδίδει τη συνολική συγκέντρωση του ενζύμου, χρησιμοποιημένου και αχρησιμοποίητου:
[E]σύνολο =[E] + [ES]
Εδώ, θα πρέπει να αντικαταστήσουμε το [E] με το [E]σύνολο -[ES]:
(([E]σύνολο -[ES])[S])/([ES]) =(k-1 + k2 )/k-1
Η έκφραση στα δεξιά ισούται με αυτό που οι χημικοί αποκαλούν σταθερά Michaelis. Αυτή η τιμή έχει χρήση στον χαρακτηρισμό της συγγένειας των ενζύμων με τα υποστρώματά τους. Οι υψηλότερες σταθερές Michaelis σημαίνουν χαμηλότερη συγγένεια, ενώ τα ζεύγη ενζύμου-υποστρώματος με υψηλή συγγένεια έχουν χαμηλές σταθερές.
KM =(k-1 + k2 )/k1
Αντικαθιστώντας τη σταθερά Michaelis στην προηγούμενη εξίσωση, μπορούμε στη συνέχεια να λύσουμε το [ES]:
(([E]σύνολο – [ES])[S])/([ES]) =KM
[ES] =([E]σύνολο [S])/(ΚΜ + [S])
Τέλος, μπορούμε να αντικαταστήσουμε αυτήν την έκφραση με το ρυθμό σχηματισμού προϊόντος. Αυτή η εξίσωση χρησιμεύει στη συνέχεια ως η αρχική ταχύτητα μιας ενζυμικής αντίδρασης:
v0 =(d[P])/t =k2 [ES]
v0 =(k2 [E]σύνολο [S])/(ΚΜ +[S])
Έτσι, χάρη στην προσέγγιση σταθερής κατάστασης, μπορούμε να εξαγάγουμε την αρχική ταχύτητα μιας αντίδρασης, μια σημαντική παράμετρο για τους βιοχημικούς που μελετούν την κινητική των ενζύμων.




