Τι είναι η ενέργεια του πλέγματος;
Βασικές έννοιες
Σε αυτό το σεμινάριο σχετικά με τηνενέργεια πλέγματος , θα καλύψουμε τον ορισμό του, τις σχετικές τάσεις του περιοδικού πίνακα, τους παράγοντες που τον επηρεάζουν και τον τρόπο υπολογισμού του.
Τι είναι η ενέργεια πλέγματος;
Κατά τον σχηματισμό στερεών ιοντικών ενώσεων, τα ηλεκτροθετικά μέταλλα αντιδρούν με ηλεκτραρνητικά αμέταλλα. Τόσο η δημιουργία όσο και η διάλυση τέτοιων ενώσεων περιλαμβάνουν την έννοια της ενέργειας πλέγματος, ενός τύπου δυναμικής ενέργειας που εκφράζεται σε μονάδες kJ/mol. Η ενέργεια του πλέγματος διατηρεί τις σταθερές θέσεις των κατιόντων και των ανιόντων εντός των ιοντικών ενώσεων. Μπορούμε να διερευνήσουμε περαιτέρω αυτόν τον όρο με δύο διαφορετικούς τρόπους, ανάλογα με την άποψή μας.
Το κλειδί για την κατανόηση αυτής της έννοιας βρίσκεται στην κρυσταλλική δομή των ιοντικών ενώσεων. Η ισχυρή, άκαμπτη σύνθεσή τους επιτρέπει τις αλληλεπιδράσεις μεταξύ κάθε φορτισμένου ιόντος και των αντίθετα φορτισμένων ομολόγων του. Αυτές οι αλληλεπιδράσεις περιλαμβάνουν μεγάλες ποσότητες ενέργειας, εξηγώντας τα υψηλά σημεία τήξης και βρασμού που είναι χαρακτηριστικά των ιοντικών ενώσεων.
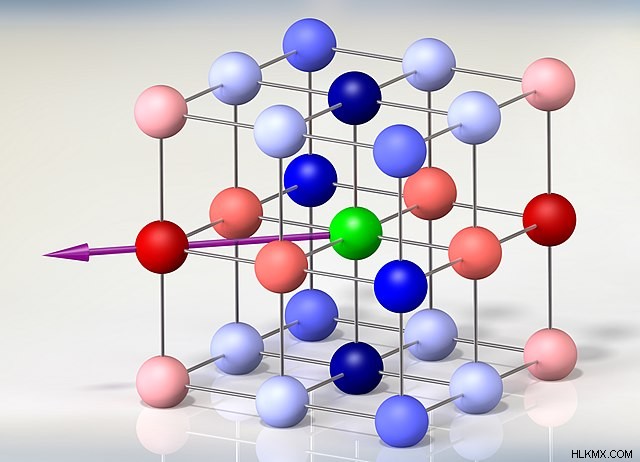
Η ενέργεια του πλέγματος μπορεί να περιγραφεί ως μια ορισμένη ποσότητα ενέργειας που απελευθερώνεται όταν τα αέρια ιόντα αντιδρούν κατά το σχηματισμό ενός γραμμομορίου μιας στερεής ιοντικής ένωσης. Ωστόσο, περιγράφει επίσης την ενέργεια που διευκολύνει τη διάσπαση ενός mol μιας στερεάς ιοντικής ένωσης στα αέρια ιόντα που την αποτελούν. Ανάλογα με τον ορισμό που επιλέξαμε, η ενέργεια πλέγματος μιας δεδομένης ιοντικής ένωσης μπορεί να είναι είτε θετική είτε αρνητική τιμή.
Εξώθερμο έναντι ενδόθερμου
Μπορούμε να δούμε τις ενέργειες του πλέγματος είτε ως ενδόθερμες είτε ως εξώθερμες διεργασίες ανάλογα με τον ορισμό στον οποίο επικεντρωνόμαστε. Μια διαδικασία είναι εξώθερμη όταν απελευθερώνει ενέργεια. Ο πρώτος μας ορισμός, ο σχηματισμός μιας ιοντικής ένωσης, περιλαμβάνει εξώθερμη ενέργεια πλέγματος, που αντιστοιχεί σε αρνητική τιμή.
Από την άλλη πλευρά, αν χρησιμοποιήσουμε τον εναλλακτικό ορισμό, τη διάλυση μιας ιοντικής ένωσης, η φύση της ενεργειακής τιμής του πλέγματος αλλάζει. Επειδή αυτή η διαδικασία απαιτεί ενέργεια, εμπίπτει στην ενδόθερμη κατηγορία, που αντιστοιχεί σε μια θετική τιμή.
Παράγοντες t καπέλο επηρεάζειΕνέργεια πλέγματος
1. Τα φορτία που κατέχουν τα συστατικά ιόντα (που αντιπροσωπεύονται από τις μεταβλητές Q1 και Q2 )
Καθώς αυξάνουμε τη μεταβλητή φορτίου ιόντων, η ενέργεια του πλέγματος αυξάνεται. Αυτό σημαίνει ότι τα ιόντα με μεγαλύτερες τιμές φορτίου θα παράγουν ιοντικές ενώσεις με μεγαλύτερες ενέργειες πλέγματος. Με τη σειρά τους, τα ιόντα που έχουν ασθενέστερα φορτία μειώνουν τις ενέργειες του πλέγματος των ενώσεων τους.
2. Η απόσταση μεταξύ των συστατικών ιόντων (που αντιπροσωπεύεται από τη μεταβλητή R)
Καθώς αυξάνουμε τη μεταβλητή απόστασης, η ενέργεια του πλέγματος μειώνεται. Ουσιαστικά, τα μεγαλύτερα ιόντα συνθέτουν ιοντικές ενώσεις με μικρότερες ενέργειες πλέγματος λόγω της αυξημένης απόστασης μεταξύ τους. Τα μικρότερα ιόντα παράγουν μεγαλύτερες ενέργειες πλέγματος στις ιοντικές ενώσεις τους.
Τάσεις ενέργειας πλέγματος
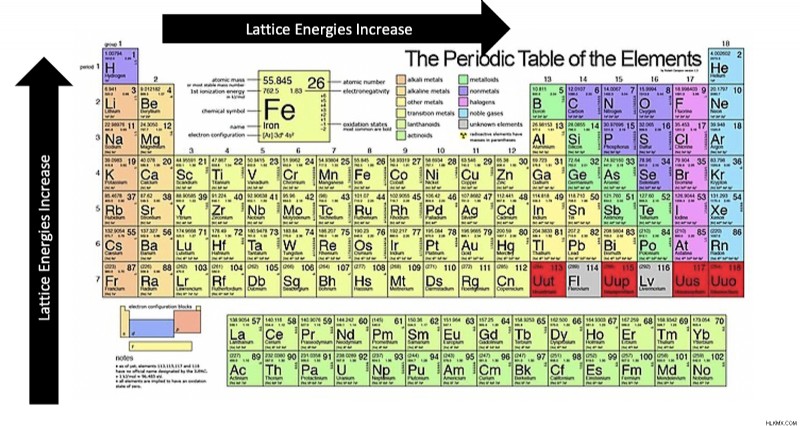
Συνοψίζοντας, η ενέργεια του πλέγματος αυξάνεται καθώς αυξάνουμε το φορτίο ιόντων και μειώνουμε την απόσταση. Πιο συγκεκριμένα, αυξάνεται από αριστερά προς τα δεξιά σε περιόδους και από κάτω προς τα επάνω στις ομάδες.
Μπορούμε να συνοψίσουμε τις τάσεις του περιοδικού πίνακα ενέργειας πλέγματος στην παρακάτω εικόνα:
Εύρεση ενεργειών πλέγματος
Όταν παρουσιάζονται με πολλαπλές ιοντικές ενώσεις, οι χημικοί πρέπει συχνά να προσδιορίζουν ποια παρουσιάζει την υψηλότερη ενέργεια πλέγματος. Για να το κάνουν αυτό, λαμβάνουν υπόψη τόσο τη μεταβλητή φορτίου ιόντων όσο και τη μεταβλητή απόστασης.
Υπολογισμός ενεργειών πλέγματος
Αν και ο υπολογισμός των ακριβών ενεργειών του πλέγματος μπορεί να αποδειχθεί περίπλοκος, συχνά απλοποιούμε τη διαδικασία χρησιμοποιώντας το νόμο του Coulomb. Αυτός ο νόμος παρέχει την ακόλουθη εξίσωση που περιγράφει την ενέργεια πλέγματος μιας δεδομένης ιοντικής ένωσης:
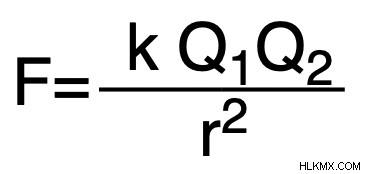
Ε1 &Ε2 =τα σχετικά φορτία των συστατικών ιόντων σε μια ιοντική ένωση
R =η απόσταση μεταξύ των φορτίσεων
K =2,31 x 10^ J-nm.
Η τελική απάντηση πρέπει να γραφτεί σε μονάδες Joules (J).
Βήματα για επίλυση:
- Λύστε την εξίσωση για κάθε ιοντική ένωση, εισάγοντας τις τιμές φορτίου και απόστασης που είναι συγκεκριμένες για αυτήν.
- Συγκρίνετε τα αποτελέσματα. η μεγαλύτερη ποσότητα υποδηλώνει την ιοντική ένωση με τη μεγαλύτερη ενέργεια πλέγματος.
Προσέγγιση ενεργειών πλέγματος
Κατά τη διάρκεια των συγκρίσεων, μπορούμε επίσης να χρησιμοποιήσουμε τις μεταβλητές φορτίου και απόστασης για να υπολογίσουμε τις σχετικές ενέργειες του πλέγματος.
Βήματα για επίλυση:
1. Πρώτα κοιτάξτε τα σχετικά φορτία που εμφανίζονται από κάθε ιόν σε μια δεδομένη ένωση—αν μια ένωση έχει πολύ υψηλότερα ιοντικά φορτία, τότε πιθανότατα θα έχει την υψηλότερη ενέργεια πλέγματος.
2. Εάν οι διαφορές φορτίου μεταξύ των ενώσεων δεν φαίνονται σαφείς, υπολογίστε το Q1 x Q2 για κάθε ένωση και συγκρίνετε αυτές τις τιμές. Για παράδειγμα, ένα υπολογιζόμενο φορτίο -3 έχει 3 φορές το μέγεθος ενός υπολογιζόμενου φορτίου -1. Αυτό θα σήμαινε ότι η ιοντική ένωση με φορτίο -3 εμφανίζει πολύ υψηλότερη ενέργεια πλέγματος από την ιοντική ένωση με φορτίο -1 (περίπου 3 φορές υψηλότερη).
3. Εάν τα φορτία πολλαπλών ενώσεων είναι ίδια ή πολύ παρόμοια σε αξία για να προκύψουν διακρίσεις, εξετάστε τα μεγέθη των ιόντων. Αντιπαραθέστε το ατομικό μέγεθος, συγκρίνοντας κατιόν με κατιόν και ανιόν με ανιόν μεταξύ των ενώσεων. Εάν δείτε μια σημαντική διαφορά στο μέγεθος είτε μεταξύ κατιόντων είτε μεταξύ ανιόντων, το συστατικό με τη μεγαλύτερη ατομική ακτίνα θα μειώσει την ενέργεια του πλέγματος της αντίστοιχης ένωσης του. Αντίθετα, το ιόν με μικρότερη ατομική ακτίνα θα αυξήσει την ενεργειακή αξία της αντίστοιχης ένωσης του.
Εφαρμογές ενέργειας πλέγματος
Ο κύκλος Born-Haber
Η ενέργεια του πλέγματος εμπλέκεται στον κύκλο Born-Haber, ο οποίος βοηθά τους χημικούς να αναλύσουν τις ενέργειες αντίδρασης. Αυτός ο κύκλος συνήθως πληροφορεί τις έρευνες σχηματισμού ιοντικής ένωσης από διαφορετικά στοιχεία. Αποσαφηνίζει τη συνολική διαδικασία αντίδρασης αναλύοντάς την σε μια σειρά βημάτων. Αυτή η προσέγγιση στην ανάλυση χημικών αντιδράσεων πηγάζει από τον νόμο του Hess, ο οποίος δηλώνει ότι οι γενικές ενεργειακές αλλαγές μπορούν να προσδιοριστούν εξερευνώντας μεμονωμένα βήματα και στη συνέχεια συνδυάζοντας τα αποτελέσματά τους.
Καθώς η ενέργεια του πλέγματος αποτελεί μέρος της εξίσωσης του κύκλου Born-Haber, μπορούμε να την λύσουμε όταν οι άλλοι παράγοντες είναι συνδεδεμένοι. Η εξίσωση έχει ως εξής:
Θερμότητα σχηματισμού =ενέργεια πλέγματος + θερμότητα ψεκασμού + ενέργεια διάστασης + (άθροισμα ενεργειών ιονισμού) + (άθροισμα συγγενειών ηλεκτρονίων)
Ο κύκλος Born-Haber εφαρμόζει τον νόμο του Hess για τον υπολογισμό των ενεργειών του πλέγματος αντιπαραθέτοντας την αλλαγή σχηματισμού της ενθαλπίας μιας δεδομένης ιοντικής ένωσης στην ενθαλπία που απαιτείται για να σχηματιστούν αέρια ιόντα από τα συστατικά της.
Άλλες εφαρμογές των ενεργειών πλέγματος
Οι επιστήμονες χρησιμοποιούν τις ενέργειες του πλέγματος ευρύτερα για να αξιολογήσουν τις σχέσεις ηλεκτρονίων και τις σχέσεις φθορίου. Οι παράγοντες, με τη σειρά τους, ενημερώνουν τις έρευνες σχετικά με τις σχετικές αντοχές διαφορετικών ιοντικών στερεών καθώς και προβλέψεις σχετικά με τις ταυτότητες, τα συστατικά και τις ιδιότητες ιοντικών ενώσεων.
Περαιτέρω Παραδείγματα υπολογισμού ενεργειών πλέγματος
Παράδειγμα s:Χρήση τεχνικών προσέγγισης
Αρχικά, θα εξασκηθούμε στην επίλυση της μεταβλητής χρέωσης.
Πρόβλημα 1: Με δεδομένη την ένωση MgO, προσδιορίστε το συνδυασμένο φορτίο της.
Βήματα για επίλυση:
1. Να γράψετε τα φορτία των ιόντων του:Mgand O
2. Πολλαπλασιάστε αυτές τις χρεώσεις:(2) x (-2) =-4
Πρόβλημα 2: Με δεδομένη την ένωση KCl, προσδιορίστε το συνδυασμένο φορτίο της.
1. Να γράψετε τα φορτία των ιόντων του:Kand Cl
2. Πολλαπλασιάστε αυτές τις χρεώσεις:(1) x (-1) =-1
Μπορούμε να συγκρίνουμε το φορτίο -4 του MgO με το φορτίο -1 του KCl όπως συζητήθηκε. Καθώς το πρώτο είναι 4 φορές η ποσότητα του δεύτερου, μπορούμε να προβλέψουμε ότι η ενέργεια του πλέγματος θα ήταν επίσης περίπου 4 φορές μεγαλύτερη.
Τώρα, θα εξασκηθούμε στην επίλυση της μεταβλητής μεγέθους.
Πρόβλημα 3: Με δεδομένη την ένωση CaO, προσδιορίστε τα μεγέθη των ιόντων της.
Βήματα για επίλυση:
1. Προσδιορίστε τις ιοντικές ακτίνες του κατιόντός του:Το Ca έχει ιοντική ακτίνα 0,100 nm.
2. Προσδιορίστε τις ιοντικές ακτίνες του ανιόντος του:Το O έχει ιοντική ακτίνα 0,140 nm.
Μπορούμε να συγκρίνουμε αυτές τις τιμές με αυτές μιας άλλης ιοντικής ένωσης όπως συζητήθηκε. Αυτό παρέχει μια εικόνα για το ποια παρουσιάζει μεγαλύτερη ενέργεια πλέγματος.
Κύκλος Born-Haber Παραδείγματα
Τώρα, θα εξασκηθούμε στην επίλυση για την ακριβή ενέργεια πλέγματος χρησιμοποιώντας τον κύκλο Born-Haber.
Πρόβλημα 1: Με δεδομένη την ένωση NaCl, προσδιορίστε την ενέργεια του πλέγματος.
Βήματα για επίλυση:
- Γράψτε την αντίδραση που περιγράφει τον σχηματισμό NaCl υπό κανονικές συνθήκες:
Na(s)+12Cl2 (ζ)→NaCl(s)
- Αλλάξτε τα αντιδρώντα στα συστατικά τους ιοντικού αερίου.
Na(s)→Na(g)
Na(g)→Na+(g)+e−
12Cl2(g)→Cl(g)
Cl(g)+e−→Cl−(g)
Na+(g)+Cl−(g)→NaCl(s)
Αυτός ο τελικός μετασχηματισμός δείχνει τη δημιουργία της ίδιας της ένωσης "πλέγμα".
3. Σύμφωνα με το νόμο του Hess, διαχωρίστε τα μέρη της αντίδρασης και εξετάστε τα μεμονωμένα.
NaCl(s)→Na(s)+12Cl2
−ΔHf,NaCl(s) =+411 kJ
Na, Δ=107 kJ
Na(g)→Na+(g)+e−
IE1,Na (g)=502 kJ
12Cl2 (g)→Cl(g)
12ΔHδεσμός,Cl2 (g)=12×242 kJ
Cl(g)+e−→Cl−(g)
EA1,Cl(g)=−355 kJ
Na+(g)+Cl−(g)→NaCl(s), ΔHπλέγμα =?
4. Συνδυάστε ξανά αυτά τα μέρη για να δώσετε την τελική εξίσωση του κύκλου Born-Habor:
0=ΔHcycle=ΔHf,NaCl(s)+ΔHsub,Na+IE1,Na(g)+12ΔHbond,Cl2(g)−EA1,Cl(g)−ΔHlattice
Στη συνέχεια, λύστε τη μεταβλητή πλέγματος:ΔHlattice,NaCl(s)
=−[411+107+502+12(242)−355]kJ
Ενέργεια πλέγματος NaCl=−786 kJ




