Τροχιακά Ηλεκτρονίων &Σχήματα Τροχιών
Τι είναι ένα τροχιακό ηλεκτρονίων;
Τροχιακά ηλεκτρονίων είναι οι τρισδιάστατες περιοχές γύρω από τον πυρήνα ενός ατόμου όπου βρίσκεται ένα συγκεκριμένο ηλεκτρόνιο. Κάθε τροχιακό μπορεί να κρατήσει δύο ηλεκτρόνια. Είναι επίσης γνωστά ως ατομικά τροχιακά. Τα ατομικά τροχιακά έχουν διαφορετικά σχήματα, ανάλογα με τον αριθμό των ηλεκτρονίων που έχει το άτομο. Θα μάθουμε για το s τροχιακό, p τροχιακό, d τροχιακό και f τροχιακό. Θα μάθουμε επίσης τα τροχιακά τους σχήματα.
Ο ακριβής ορισμός ενός τροχιακού, είναι μια μαθηματική συνάρτηση που περιγράφει τη θέση ενός ηλεκτρονίου σε ένα άτομο, με βάση την πιθανότητα. Ο όρος "ατομικό τροχιακό" αναφέρεται γενικά στην περιοχή του χώρου όπου θα μπορούσε να υπάρχει ένα ηλεκτρόνιο, με βάση τη μαθηματική συνάρτηση για αυτό το τροχιακό.
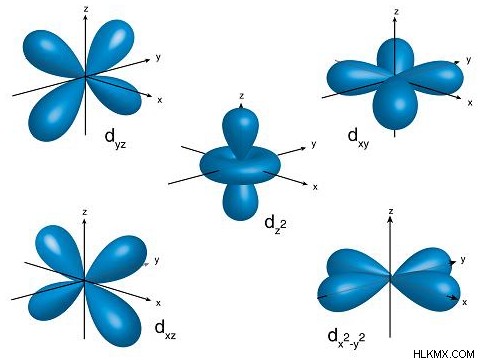
Τα εκφυλισμένα τροχιακά είναι τροχιακά στο ίδιο κύριο ενεργειακό επίπεδο και υποεπίπεδο που έχουν διαφορετικούς προσανατολισμούς. Για παράδειγμα, οι 5 προσανατολισμοί των d-τροχιακών στο τρισδιάστατο επίπεδο είναι εκφυλισμένα τροχιακά.
Βασική επισκόπηση των κβαντικών αριθμών
Για περισσότερες λεπτομέρειες σχετικά με τους κβαντικούς αριθμούς, ανατρέξτε στο άρθρο μας για τους κβαντικούς αριθμούς! Υπάρχουν τέσσερις κβαντικοί αριθμοί που λένε το επίπεδο ενέργειας, το σχήμα, τον προσανατολισμό και το σπιν ηλεκτρονίων των τροχιακών.
- Κύριος κβαντικός αριθμός (n ):δείχνει το κύριο ενεργειακό επίπεδο ενός ηλεκτρονίου. Όσο μεγαλύτερος είναι ο κύριος κβαντικός αριθμός, τόσο υψηλότερο είναι το επίπεδο ενέργειας και επομένως τόσο μεγαλύτερη είναι η απόσταση μεταξύ του πυρήνα και του συγκεκριμένου ηλεκτρονίου.
- Κβαντικός αριθμός γωνιακής ορμής (l ):δηλώνει το σχήμα ενός τροχιακού. Διαφορετικές τιμές του l αντιστοιχούν σε συγκεκριμένα σχήματα τροχιακών ηλεκτρονίων. Αυτό θα συζητηθεί λεπτομερέστερα αργότερα.
- Μαγνητικός κβαντικός αριθμός (m ):δείχνει τον προσανατολισμό ενός τροχιακού γύρω από τον πυρήνα. Επειδή τα διαφορετικά τροχιακά έχουν διαφορετικά σχήματα, μπορούν να περιστραφούν γύρω από ένα επίπεδο συντεταγμένων 3D με πολλούς προσανατολισμούς.
- Spin Quantum Number:υποδεικνύει την κατεύθυνση στην οποία περιστρέφεται ένα ηλεκτρόνιο σε ένα τροχιακό. Υπάρχουν μόνο δύο πιθανές τιμές του κβαντικού αριθμού σπιν:-1/2 και +1/2. Υπάρχουν το πολύ δύο ηλεκτρόνια ανά τροχιακό, και εάν και τα δύο βρίσκονται στο τροχιακό, πρέπει να περιστρέφονται προς τις αντίθετες κατευθύνσεις (που σημαίνει ότι έχουν τον αντίθετο κβαντικό αριθμό σπιν).
Κβαντικός αριθμός γωνιακής ορμής &τροχιακά σχήματα
Ο κβαντικός αριθμός γωνιακής ορμής έχει ακέραιες τιμές από 0 έως (n -1). Έτσι, εάν ο κύριος κβαντικός αριθμός (n ) =4, οι κβαντικοί αριθμοί γωνιακής ορμής είναι 0, 1, 2 και 3.
Κάθε κβαντικός αριθμός γωνιακής ορμής αντιπροσωπεύει ένα γράμμα, το οποίο αντιστοιχεί σε ένα συγκεκριμένο σχήμα ενός τροχιακού. Όπως μπορείτε να δείτε, όσο μεγαλύτερος είναι ο κύριος κβαντικός αριθμός, τόσο υψηλότερος είναι ο κβαντικός αριθμός της γωνιακής ορμής και τόσο πιο σύνθετο γίνεται το τροχιακό σχήμα. Κυρίως, θα χρειαστεί να γνωρίζετε μόνο τα τροχιακά s, p τροχιακά, d τροχιακά και f — μετά το τροχιακό f, τα σχήματα γίνονται πολύ περίπλοκα.
| Κύριο κβαντικό # (n ) | Γωνιακή ορμή Κβαντική # (l ) | Επιστολή | Διάγραμμα τροχιακού σχήματος |
| 1 | 0 | s | 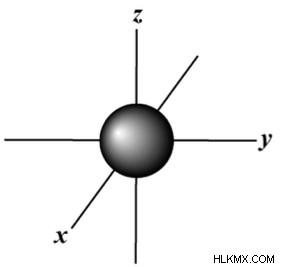 |
| 2 | 1 | p | 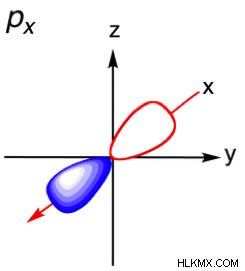 |
| 3 | 2 | d | 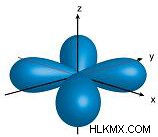 |
| 4 | 3 | f |  |
Πώς τα ηλεκτρόνια καταλαμβάνουν τον τροχιακό χώρο;
S τροχιακό
Στο πρώτο κύριο επίπεδο ενέργειας, όταν n =1, το μόνο υποεπίπεδο, ή τροχιακό, δυνατό είναι το s-τροχιακό, το οποίο έχει σχήμα σφαίρας.
Π τροχιακό
Όταν n =2, είναι δυνατά δύο υποεπίπεδα:αυτά είναι τα s-τροχιακά και p-τροχιακά. Αν θυμάστε, ο μαγνητικός κβαντικός αριθμός δείχνει τους προσανατολισμούς ενός τροχιακού, με τις τιμές –l σε +l . Έτσι ένα s-τροχιακό έχει μόνο έναν μαγνητικό κβαντικό αριθμό που είναι 1, που σημαίνει ότι έχει μόνο έναν πιθανό προσανατολισμό. Αυτό είναι λογικό γιατί μια σφαίρα έχει το ίδιο σχήμα ανεξάρτητα από το πώς περιστρέφεται. Έτσι, ένα p-τροχιακό έχει τρεις πιθανούς προσανατολισμούς (-1, 0, 1 μαγνητικούς κβαντικούς αριθμούς).
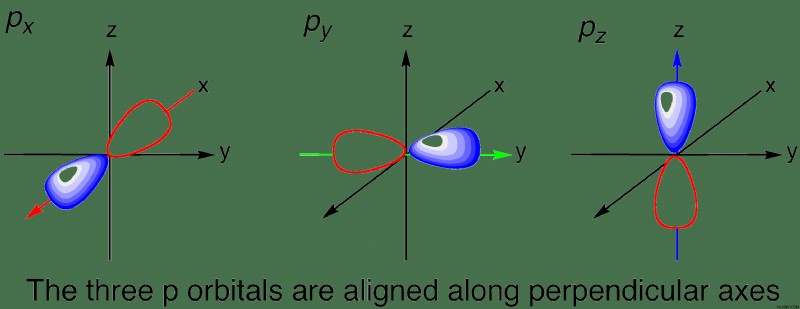
Το νέον, το τελευταίο στοιχείο στο κύριο δεύτερο ενεργειακό επίπεδο, έχει 10 ηλεκτρόνια. Πώς κατανέμονται και εντοπίζονται αυτά τα ηλεκτρόνια; Τα πρώτα 2 ηλεκτρόνια πηγαίνουν στο 1s-τροχιακό, ή το s-τροχιακό στο πρώτο κύριο επίπεδο ενέργειας. Στη συνέχεια, τα επόμενα 2 ηλεκτρόνια καταλαμβάνουν στο 2s-τροχιακό, ή το s-τροχιακό στο δεύτερο κύριο ενεργειακό επίπεδο. Θυμηθείτε, επειδή υπάρχει μόνο ένας προσανατολισμός ενός s-τροχιακού, υπάρχει μόνο ένα s-τροχιακό ανά επίπεδο ενέργειας. Τέλος, τα τελευταία 6 ηλεκτρόνια χωρίζονται ομοιόμορφα στα 2p-τροχιακά. Εφόσον υπάρχουν τρεις προσανατολισμοί ενός p-τροχιακού, υπάρχουν τρία p-τροχιακά ανά επίπεδο ενέργειας.
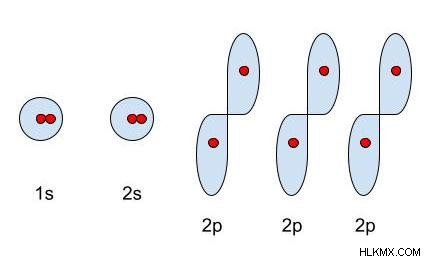
Όπως φαίνεται στο παραπάνω παράδειγμα, τα ηλεκτρόνια μπορούν να αναγνωριστούν από τα τροχιακά στα οποία βρίσκονται. Οι διαμορφώσεις ηλεκτρονίων δείχνουν πώς τα ηλεκτρόνια είναι οργανωμένα σε τροχιακά σε ένα άτομο.
Μάθετε περισσότερα
Δείτε μερικά από τα άλλα σχετικά άρθρα μας!
- Τι είναι η συγγένεια ηλεκτρονίων;
- Τι είναι τα ηλεκτρόνια σθένους;
- Αρχή Aufbau




