Διαφορά μεταξύ Sigma και Pi Bond
Κύρια διαφορά – Sigma vs Pi Bond
Οι δεσμοί Sigma και pi χρησιμοποιούνται για να περιγράψουν ορισμένα χαρακτηριστικά ομοιοπολικών δεσμών και μορίων με τρία ή δύο άτομα. Αυτοί οι δεσμοί σχηματίζονται από επικάλυψη ατελών s και p τροχιακά δύο ατόμων που συμμετέχουν στον δεσμό. Ως εκ τούτου, αυτό το μοντέλο αναφέρεται συχνά ως μοντέλο επικάλυψης. Το μοντέλο εφαρμόζεται κυρίως για να εξηγήσει το σχηματισμό δεσμών μικρότερων ατόμων και δεν είναι εφαρμόσιμο για να εξηγήσει τη σύνδεση μεγαλύτερων μορίων. Η κύρια διαφορά μεταξύ του δεσμού σίγμα και του δεσμού pi είναι ο σχηματισμός τους. η αξονική επικάλυψη δύο τροχιακών σχηματίζει δεσμό σίγμα ενώ η πλευρική επικάλυψη δύο τροχιακών σχηματίζει δεσμό pi .
Αυτό το άρθρο εξερευνά,
1. Τι είναι το Sigma Bond
– Ορισμός, Χαρακτηριστικά, Ιδιότητες
2. Τι είναι το Pi Bond
– Ορισμός, Χαρακτηριστικά, Ιδιότητες
3. Ποια είναι η διαφορά μεταξύ Sigma και Pi Bond
Τι είναι ο δεσμός Sigma
Η ομοαξονική ή γραμμική επικάλυψη ατομικών τροχιακών δύο ατόμων σχηματίζει έναν δεσμό σίγμα. Είναι ο πρωταρχικός δεσμός που βρίσκεται σε απλούς, διπλούς και τριπλούς δεσμούς. Ωστόσο, μπορεί να υπάρχει μόνο ένας δεσμός σίγμα μεταξύ δύο ατόμων. Ο δεσμός σίγμα είναι ισχυρότερος από τον δεσμό π, επειδή ο δεσμός σίγμα έχει τη μέγιστη επικάλυψη των ατομικών τροχιακών. Περιέχει ένα μόνο νέφος ηλεκτρονίων, το οποίο βρίσκεται κατά μήκος του άξονα του δεσμού. Ο δεσμός Sigma είναι ο πρώτος δεσμός που σχηματίζεται κατά το σχηματισμό ενός ομοιοπολικού δεσμού. Σε αντίθεση με τους δεσμούς pi, τόσο τα υβριδισμένα όσο και τα μη υβριδισμένα τροχιακά σχηματίζουν δεσμούς σίγμα.
Τι είναι ο δεσμός Pi
Ο δεσμός Pi σχηματίζεται από πλευρική ή πλάγια ή παράλληλη επικάλυψη ατομικών τροχιακών. Αυτοί οι δεσμοί είναι πιο αδύναμοι από τους δεσμούς σίγμα λόγω της ελάχιστης έκτασης επικάλυψης. Επιπλέον, οι δεσμοί pi σχηματίζονται μετά το σχηματισμό δεσμών σίγμα. Ως εκ τούτου, αυτοί οι δεσμοί υπάρχουν πάντα με δεσμό σίγμα. Οι δεσμοί pi σχηματίζονται με επικάλυψη μη υβριδισμένων ατομικών τροχιακών p-p. Σε αντίθεση με τους δεσμούς σίγμα, οι δεσμοί pi δεν επηρεάζουν το σχήμα ενός μορίου. Οι μεμονωμένοι δεσμοί είναι δεσμοί σίγμα. Αλλά οι διπλοί και τριπλοί δεσμοί έχουν έναν και δύο δεσμούς pi αντίστοιχα, μαζί με έναν δεσμό σίγμα.
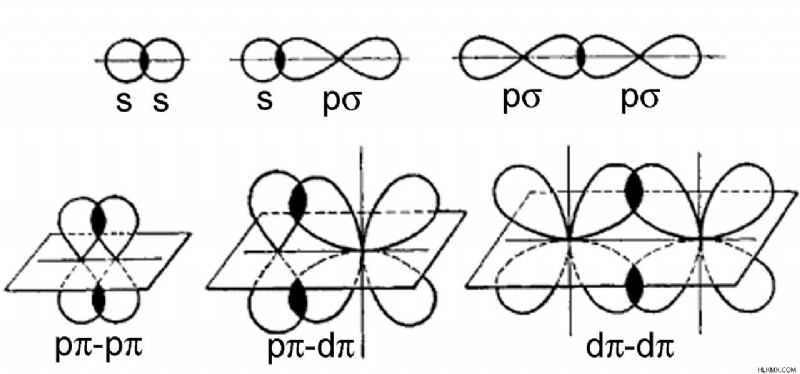
Εικόνα 01:Δεσμός Sigma και δεσμός Pi
Διαφορά μεταξύ Sigma και Pi Bond
Σχηματισμός Ομολογιών
Sigma Bond: Οι δεσμοί Sigma σχηματίζονται από την αξονική επικάλυψη μισογεμάτων ατομικών τροχιακών ατόμων.
Πι Μποντ: Οι δεσμοί Pi σχηματίζονται από την πλευρική επικάλυψη των ημιγεμάτων ατομικών τροχιακών των ατόμων.
Επικαλυπτόμενα τροχιακά
Sigma Bond: Στους δεσμούς σίγμα, τα επικαλυπτόμενα τροχιακά μπορεί να είναι:δύο υβριδικά τροχιακά ή ένα υβριδικό και ένα καθαρό τροχιακό ή δύο καθαρά τροχιακά
Πι Μποντ: Στους δεσμούς pi, τα επικαλυπτόμενα τροχιακά είναι πάντα δύο καθαρά (δηλαδή μη υβριδισμένα) τροχιακά.
Ύπαρξη
Sigma Bond: Ο δεσμός Sigma υπάρχει ανεξάρτητα.
Πι Μποντ: Το Pi-bond υπάρχει πάντα μαζί με το sigma bond.
Περιστροφή δύο ατόμων άνθρακα
Sigma Bond: Το Sigma bond επιτρέπει την ελεύθερη περιστροφή.
Πι Μποντ: Ο δεσμός Pi περιορίζει την ελεύθερη περιστροφή.
Ισχύς δεσμού
Sigma Bond: Οι δεσμοί Sigma είναι ισχυρότεροι από τους δεσμούς pi.
Πι Μποντ: Οι δεσμοί Pi είναι λιγότερο ισχυροί από τους δεσμούς σίγμα.
Εντολή σχηματισμού ομολόγου
Sigma Bond: Όταν τα άτομα πλησιάζουν, σχηματίζονται πρώτοι δεσμοί σίγμα.
Πι Μποντ: Ο σχηματισμός δεσμών pi προηγείται από το σχηματισμό δεσμών σίγμα.
Αριθμός ομολόγων
Sigma Bond: Υπάρχει μόνο ένας δεσμός σίγμα μεταξύ δύο ατόμων.
Πι Μποντ: Μπορεί να υπάρχουν δύο δεσμοί pi μεταξύ δύο ατόμων.
Έλεγχος της Γεωμετρίας σε Πολυατομικά Μόρια
Sigma Bond: Μόνο οι δεσμοί σίγμα εμπλέκονται στον έλεγχο της γεωμετρίας στα πολυατομικά μόρια.
Πι Μποντ: Οι δεσμοί Pi δεν εμπλέκονται στον έλεγχο της γεωμετρίας στα πολυατομικά μόρια.
Αριθμός δεσμών σε διπλό δεσμό
Sigma Bond: Υπάρχει ένας δεσμός σίγμα σε έναν διπλό δεσμό.
Πι Μποντ: Υπάρχει μόνο ένας δεσμός pi σε έναν διπλό δεσμό.
Αριθμός δεσμών σε τριπλό δεσμό
Sigma Bond: Υπάρχει ένας δεσμός σίγμα σε έναν τριπλό δεσμό.
Πι Μποντ: Υπάρχουν δύο δεσμοί pi σε έναν τριπλό δεσμό.
Συμμετρία του φορτίου
Sigma Bond: Ο δεσμός Sigma έχει κυλινδρική συμμετρία φορτίου γύρω από τον άξονα του δεσμού.
Πι Μποντ: Ο δεσμός Pi δεν έχει συμμετρία.
Αντιδραστικότητα
Sigma Bond: Τα ομόλογα Sigma είναι πιο αντιδραστικά.
Πι Μποντ: Οι δεσμοί Pi είναι λιγότερο αντιδραστικοί.
Προσδιορισμός σχήματος
Sigma Bond: Το σχήμα ενός μορίου καθορίζεται από τον δεσμό σίγμα.
Pi Bond: Το σχήμα ενός μορίου δεν καθορίζεται από τον δεσμό pi.
Σύνοψη
Το σίγμα και το π είναι δύο τύποι δεσμών που σχηματίζονται λόγω των επικαλυπτόμενων δύο ατομικών τροχιακών. Η αξονική επικάλυψη δύο ατόμων σχηματίζει έναν δεσμό σίγμα, ενώ η πλευρική επικάλυψη δύο ατομικών τροχιακών σχηματίζει έναν δεσμό σίγμα. Αυτή είναι η βασική διαφορά μεταξύ του δεσμού sigma και του pi. Ο δεσμός Sigma σχηματίζεται πάντα πρώτος και είναι ισχυρότερος από τον δεσμό pi. Ένας απλός δεσμός είναι πάντα ένας δεσμός σίγμα, ενώ ο διπλός δεσμός και ο τριπλός δεσμός έχουν έναν και δύο δεσμούς pi αντίστοιχα μαζί με έναν δεσμό σίγμα.
Αναφορές
1. MOHAPATRA, R. K. (2014). ΜΗΧΑΝΙΚΗ ΧΗΜΕΙΑ ΓΙΑ ΔΙΠΛΩΜΑ . PHI Learning Pvt. Ltd..
2. Srivastava, A. K. (2002). Η οργανική χημεία έγινε απλή . New Age International.
3. Jespersen, N. D., &Hyslop, A. (2014). Χημεία:The Molecular Nature of Matter:The Molecular Nature of Matter. Wiley Global Education.




