Συνδυασμένος νόμος για τα αέρια
Ο συνδυασμένος νόμος των αερίων ορίζει τη σχέση μεταξύ πίεσης, θερμοκρασίας και όγκου. Προέρχεται από τρία άλλα ονόματα νόμοι για τα αέρια, συμπεριλαμβανομένου του νόμου του Charles, του νόμου του Boyle και του νόμου του Gay-Lussac. Παρακάτω εξηγούμε την εξίσωση του νόμου, πώς προκύπτει και παρέχουμε προβλήματα πρακτικής με λύσεις.
Ο νόμος του συνδυασμένου αερίου
Ο συνδυασμένος νόμος των αερίων συσχετίζει την πίεση, τη θερμοκρασία και τον όγκο όταν όλα τα άλλα παραμένουν σταθερά (κυρίως τα γραμμομόρια αερίου, n). Η πιο κοινή μορφή της εξίσωσης για το συνδυασμένο νόμο αερίων είναι η εξής:
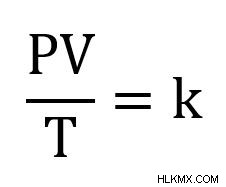
P είναι η πίεση του αερίου. T είναι η θερμοκρασία του αερίου. V είναι ο όγκος του αερίου. Και το k είναι σταθερά. Η ακριβής τιμή του k θα εξαρτηθεί από τα mol του αερίου.
Ο συνδυασμένος νόμος των αερίων γράφεται επίσης συχνά ως δύο διαφορετικά χρονικά σημεία. Δηλαδή:
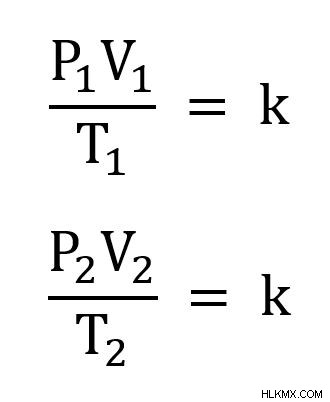
Και τα δύο k έχουν την ίδια τιμή και επομένως μπορούν να οριστούν ίσα μεταξύ τους. Προκύπτει η παρακάτω εξίσωση:
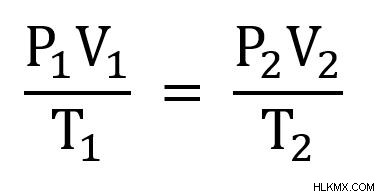
Η σχέση του συνδυασμένου νόμου των αερίων λειτουργεί όσο τα αέρια λειτουργούν ως ιδανικά αέρια. Γενικά, αυτό ισχύει όταν η θερμοκρασία είναι υψηλή και η πίεση είναι χαμηλή. Μπορείτε να μάθετε περισσότερα σχετικά με το τι κάνει ένα αέριο ιδανικό αέριο στο άρθρο «Ο νόμος του ιδανικού αερίου».
Παραγωγή του νόμου συνδυασμένου αερίου
Ο συνδυασμένος νόμος των αερίων προέρχεται από το συνδυασμό του νόμου του Charles, του νόμου του Boyle και του νόμου του Gay-Lussac.
Ο νόμος του Charle δίνει τη σχέση μεταξύ όγκου και θερμοκρασίας. Δηλαδή V/T =k. Ο νόμος του Boyle μας λέει ότι P*V =k. Και τέλος, ο νόμος του Gay-Lussac μας λέει ότι P*T =k.
Όταν όλες αυτές οι σχέσεις συνδυάζονται σε μια εξίσωση, παίρνουμε τον συνδυασμένο νόμο αερίων.
Όταν ο νόμος του συνδυασμένου αερίου διαστέλλεται και τα mol του αερίου (n) δεν διατηρούνται σταθερά, παίρνετε τον νόμο του ιδανικού αερίου. Μπορείτε επίσης να δουλέψετε backwa από τον νόμο του ιδανικού αερίου για να λάβετε τους άλλους νόμους αερίων κρατώντας διαφορετικές μεταβλητές σταθερές. Στην περίπτωση του συνδυασμένου νόμου αερίων, αυτό θα συνέβαινε κρατώντας σταθερά τα mol του αερίου (n).
Παράδειγμα προβλήματος 1
Ας υποθέσουμε ότι έχετε ένα δείγμα αερίου στους 303K σε ένα δοχείο με όγκο 2L και πίεση 760mmHg. Το δείγμα μετακινείται σε θερμοκρασία 340 K και ο όγκος αυξάνεται ελαφρά στα 2,1 L. Ποια είναι η πίεση του δείγματος τώρα;
Λύση:
Εδώ εξετάζουμε δύο διαφορετικές καταστάσεις. Η αρχική κατάσταση με δείκτη 1 και η δεύτερη κατάσταση με δείκτη 2. Αρχικά, γράψτε τις μεταβλητές που γνωρίζουμε:
V1 =2 L
T1 =303 K
P1 =760 mmHg
V2 =2,1 L
T2 =340 K
P2 =?
Γνωρίζουμε όλες τις μεταβλητές εκτός από την P2 . Μπορούμε επίσης να πούμε ότι εξετάζουμε μια κατάσταση πριν και μετά, επομένως θέλουμε να χρησιμοποιήσουμε την ακόλουθη εξίσωση.
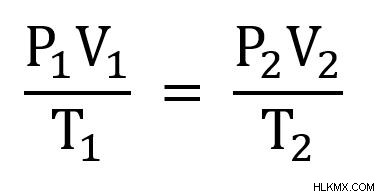
Στη συνέχεια, αναδιατάσσουμε την εξίσωση έτσι ώστε να λύνεται για P2 . Αρχικά, πολλαπλασιάστε κάθε πλευρά με T2 .
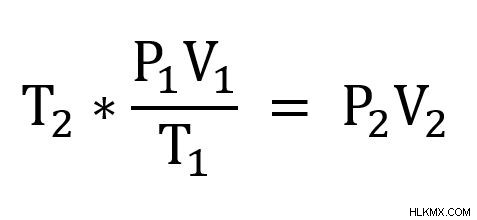
Στη συνέχεια διαιρέστε κάθε πλευρά με V2 .
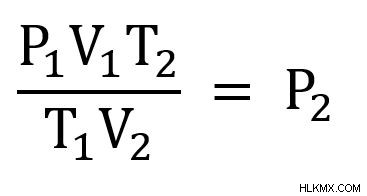
Τώρα συνδέουμε τις μεταβλητές που γνωρίζουμε και λύνουμε.
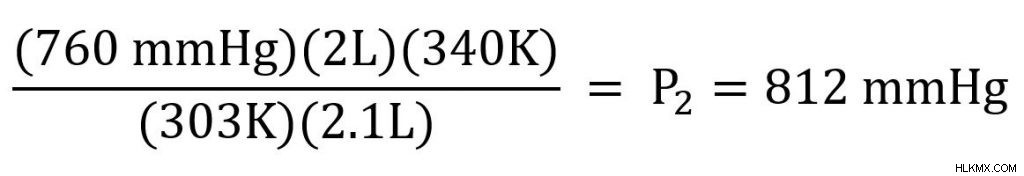
Η τελική μας πίεση είναι 812 mmHg. Παρατηρήστε επίσης ότι όλες οι μονάδες ακυρώνουν εκτός από τις μονάδες πίεσης.
Παράδειγμα προβλήματος 2
Συλλέγετε ένα αέριο στα 620 mmHg και 177 K. Κατά τη στιγμή της συλλογής, καταλαμβάνει όγκο 1,3 L. Ποιος θα είναι ο όγκος του αερίου όταν μετακινηθεί σε τυπική θερμοκρασία και πίεση;
Λύση:
Εδώ εξετάζουμε δύο διαφορετικές καταστάσεις του αερίου, την κατάσταση 1 και την κατάσταση 2. Επομένως, θα χρησιμοποιήσουμε την ακόλουθη μορφή του συνδυασμένου νόμου των αερίων.
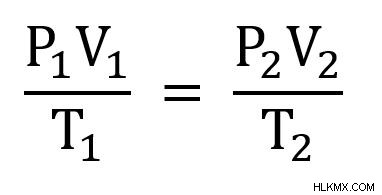
Το πρώτο βήμα είναι να προσδιορίσουμε τις μεταβλητές που γνωρίζουμε. Η πίεση, η θερμοκρασία και ο όγκος δίνονται για την αρχική κατάσταση 1. Και η πίεση και η θερμοκρασία δίνονται για την κατάσταση 2 επειδή η τυπική θερμοκρασία και πίεση ορίζονται ως 760 mmHg και 273K. Η μόνη μεταβλητή που δεν γνωρίζουμε είναι ο τόμος 2, τον οποίο πρέπει να λύσουμε.
T1 =177 K
P1 =620 mmHg
V1 =1,3 L
T2 =273 K
P2 =760 mmHg
V2 =?
Για να κάνουμε τα μαθηματικά πιο απλά, ας αναδιατάξουμε την εξίσωση που θα λύσουμε για το V2 πριν συνδέσετε τις τιμές. Για να γίνει αυτό, πολλαπλασιάζουμε και τις δύο πλευρές με T2 και μετά διαιρέστε με P2 .
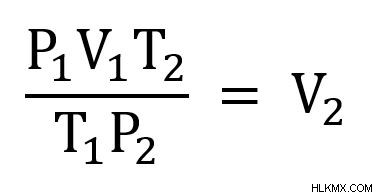
Τώρα συνδέουμε τις τιμές που γνωρίζουμε και λύνουμε.
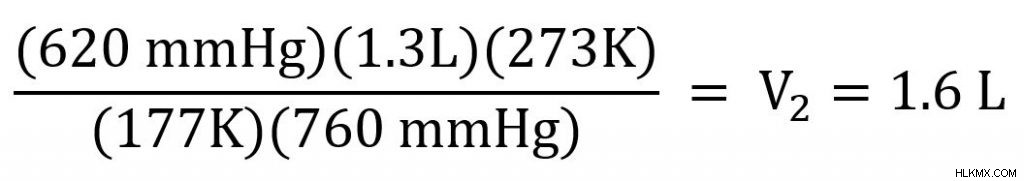
Ο νέος όγκος του αερίου είναι 1,6L. Έτσι, καθώς αυξανόταν η θερμοκρασία και η πίεση του αερίου, αυξήθηκε και ο όγκος του αερίου.
Άλλοι νόμοι για το αέριο
- Νόμος του Καρόλου
- Νόμος του Μπόιλ
- Νόμος του Gay-Lussac
- Νόμος για το ιδανικό αέριο
- Νόμος του Ντάλτον
- Νόμος του Avogadro
- Νόμος του Χένρι




