Η εξίσωση του νόμου του Raoult
Ο νόμος του Raoult χρησιμοποιείται για τον προσδιορισμό της τάσης ατμών ιδανικών διαλυμάτων με μη πτητικές διαλυμένες ουσίες με βάση την τάση ατμών του διαλύτη και το μοριακό κλάσμα του διαλύτη. Παρακάτω θα συζητήσουμε ποια είναι η εξίσωση του νόμου του Raoult, θα εξετάσουμε μια εξήγηση του τρόπου λειτουργίας του νόμου και θα μοιραστούμε μερικά παραδείγματα προβλημάτων.
Η εξίσωση του νόμου του Raoult
Η εξίσωση του νόμου του Raoult για τις μη πτητικές ουσίες είναι παρακάτω:
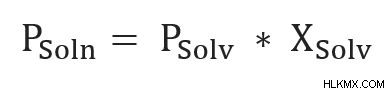
- Psoln είναι η τάση ατμών του διαλύματος.
- Psolv είναι η τάση ατμών του διαλύτη στην ίδια θερμοκρασία που μετριέται το διάλυμα.
- Xsolv είναι το μοριακό κλάσμα του διαλύτη στο διάλυμα.
Εξήγηση του νόμου του Raoult
Ο νόμος του Raoult χρησιμοποιείται με διαλύματα με μη πτητικές διαλυμένες ουσίες για τον προσδιορισμό της τάσης ατμών του διαλύματος. Η τάση ατμών του διαλύματος εξαρτάται από την τάση ατμών του καθαρού διαλύτη και το μοριακό κλάσμα του διαλύτη στο διάλυμα.
Καθώς η ποσότητα της διαλυμένης ουσίας στο διάλυμα αυξάνεται, η τάση ατμών του διαλύματος θα μειωθεί. Η απόλυτη τιμή της τάσης ατμών θα εξαρτηθεί από την αρχική τάση ατμών του διαλύτη.

Αυτή η φόρμουλα λειτουργεί καλύτερα για ιδανικά διαλύματα και μη πτητικές διαλυμένες ουσίες. Μια μη πτητική διαλυμένη ουσία δεν τείνει να εξατμίζεται. Για παράδειγμα, αλάτι στο αλμυρό νερό. Όταν το νερό εξατμίζεται αφήνει πίσω το αλάτι.
Για μια ανανέωση σχετικά με τον τρόπο προσδιορισμού του μοριακού κλάσματος, ανατρέξτε σε αυτό το άρθρο. Με απλά λόγια, το γραμμομοριακό κλάσμα του διαλύτη είναι τα mol του διαλύτη διαιρεμένα με τα συνολικά mole στο διάλυμα.
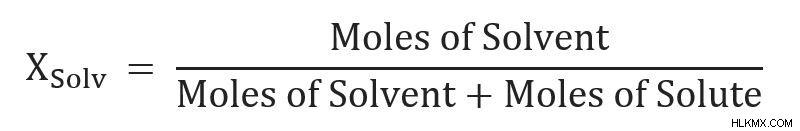
Περιορισμοί του νόμου του Raoult
Ο νόμος του Raoult δεν λειτουργεί τέλεια σε όλες τις περιπτώσεις. Παρακάτω είναι οι δύο κύριοι περιορισμοί του νόμου.
Ιδανική λύση – Η λύση πρέπει να είναι μια ιδανική λύση για να εφαρμοστεί ο νόμος του Raoult. Μια ιδανική λύση δεν είναι πολύ συμπυκνωμένη ή πολύ πολύ αραιή. Θα πρέπει επίσης να υπάρχουν παρόμοιες διαμοριακές δυνάμεις μεταξύ διαλυμένης ουσίας και διαλύτη όπως υπήρχαν μεταξύ μορίων μόνο διαλύτη για μια ιδανική λύση.
Moles of Solute – Πρέπει να ληφθεί υπόψη εάν η διαλυμένη ουσία διασπάται σε διάλυμα. Για παράδειγμα, εάν προστεθεί NaCl (άλας) στο νερό, θα διασπαστεί σε Na και Cl. Αυτά θα δράσουν στη συνέχεια διπλάσια mole διαλυμένης ουσίας από τα mol NaCl που προστέθηκαν. Αυτό πρέπει να ληφθεί υπόψη.
Γιατί εμφανίζεται αυτό το αποτέλεσμα;
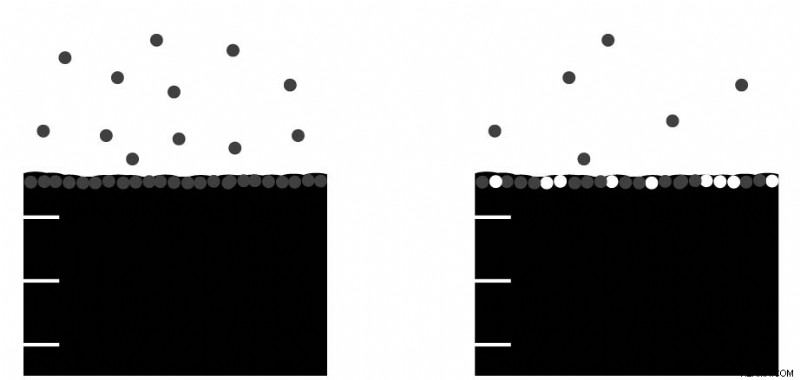
Η μειωμένη τάση ατμών με την αύξηση της συγκέντρωσης της διαλυμένης ουσίας οφείλεται στα μόρια στην επιφάνεια. Όταν είναι καθαρός διαλύτης, όλα τα μόρια στην επιφάνεια είναι μόρια διαλύτη. Αυτά τα επιφανειακά μόρια είναι επίσης αυτά που θα διαχωριστούν στη φάση του ατμού. Καθώς η συγκέντρωση της διαλυμένης ουσίας αυξάνεται, υπάρχουν λιγότερα μόρια διαλύτη στην επιφάνεια για να διαφύγουν στη φάση ατμού. Μερικές από αυτές τις επιφανειακές κηλίδες καταλαμβάνονται τώρα από μόρια διαλυμένης ουσίας. Αυτό μειώνει τη συνολική τάση ατμών.
Παράδειγμα προβλήματος lem
Παράδειγμα προβλήματος:
Θεωρήστε ένα διάλυμα αιθανόλης στους 25 C. Προσθέτετε 25 γραμμάρια σακχαρόζης (342,3 g/mol) σε 200 γραμμάρια αιθανόλης (46,07 g/mol). Η αρχική πίεση ατμών για την αιθανόλη ήταν 44 torr. Ποια είναι η νέα τάση ατμών του διαλύματος αιθανόλης και σακχαρόζης στους 25 C;
Δουλευμένο Παράδειγμα Λύσης:
Σε αυτό το παράδειγμα ο διαλύτης μας είναι η αιθανόλη και η διαλυμένη μας ουσία είναι η σακχαρόζη. Με βάση την εξίσωση του Raoult, για να προσδιορίσουμε τη νέα τάση ατμών πρέπει να γνωρίζουμε την αρχική τάση ατμών του διαλύτη και το νέο μοριακό κλάσμα του διαλύτη.
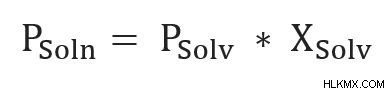
Η ερώτηση μας λέει την αρχική τάση ατμών, Psolv , είναι 44 torr. Η μόνη άλλη μεταβλητή που χρειαζόμαστε είναι το μοριακό κλάσμα του διαλύτη, Xsolv .
Για να βρούμε το γραμμομοριακό κλάσμα του διαλύτη, πρέπει πρώτα να μετατρέψουμε τα γραμμάρια σακχαρόζης και τα γραμμάρια αιθανόλης μας σε mole.
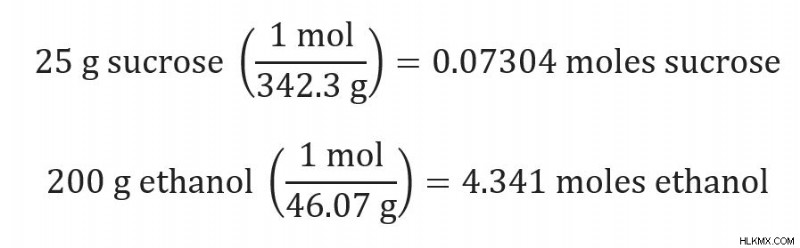
Τότε μπορούμε να λύσουμε για το μοριακό κλάσμα του διαλύτη:
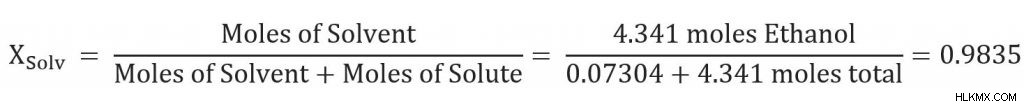
Τώρα έχουμε όλες τις μεταβλητές που χρειαζόμαστε και μπορούμε να τις συνδέσουμε στην εξίσωση του νόμου του Raoult.

Η τελική απάντηση είναι μια τάση ατμών 43,27 Torr. Η πίεση μειώνεται κατά 0,73 Torr λόγω της διαλυμένης ουσίας στο διάλυμα.
Πειραματικοί τρόποι για την παρατήρηση του νόμου του Raoult
Υπάρχουν πολλά πειράματα που μπορείτε να κάνετε για να παρατηρήσετε τον νόμο του Raoult σε δράση!
Αρχικά, θα μπορούσατε να συγκρίνετε τον ρυθμό εξάτμισης ενός ποτηριού ζέσεως ενός καθαρού διαλύτη με ένα ποτήρι ζέσεως του διαλύματος από τον ίδιο διαλύτη. Βεβαιωθείτε ότι και τα δύο ποτήρια έχουν τον ίδιο όγκο του συνολικού διαλύματος. Αφού σας αφήσετε να καθίσετε για μια μέρα περίπου, θα υπάρχει μια αξιοσημείωτη διαφορά στον όγκο μεταξύ των δύο. Ο καθαρός διαλύτης θα εξατμιστεί πιο γρήγορα επειδή έχει υψηλότερη τάση ατμών.
Ένας δεύτερος τρόπος για να παρατηρήσετε τον νόμο του Raoult είναι να χρησιμοποιήσετε ένα μανόμετρο. Το μανόμετρο είναι ένα κλειστό δοχείο που συνδέεται με ένα σωλήνα σχήματος U με υδράργυρο μέσα. Το άλλο άκρο του σωλήνα είναι ανοιχτό στην ατμόσφαιρα. Χρησιμοποιώντας το μανόμετρο, μπορούσε να μετρηθεί η τάση ατμών τόσο του καθαρού διαλύτη όσο και του διαλύματος.