Νόμος Beer-Lambert
Ο νόμος Beer-Lambert λέει ότι η ποσότητα του φωτός που απορροφάται από ένα δείγμα σχετίζεται άμεσα με τον όγκο του δείγματος από το οποίο περνά το φως και τη συγκέντρωση του δείγματος. Αναφέρεται επίσης ως νόμος της μπύρας.
Τι είναι ο νόμος Beer-Lambert;
Ο νόμος Beer-Lambert συσχετίζει τη συγκέντρωση ενός δείγματος με την ποσότητα φωτός που απορροφά το δείγμα καθώς περνά μέσα από το δείγμα. Η εξίσωση για τον νόμο Beer-Lambert γράφεται γενικά ως:
A=ϵLc
A=Απορρόφηση
ϵ =Μοριακός συντελεστής εξαφάνισης
L =Μήκος διαδρομής
C =Συγκέντρωση του δείγματος
Η απορρόφηση σχετίζεται με την αναλογία της έντασης του φωτός που εισέρχεται στο δείγμα και εξέρχεται από το δείγμα.
A =log10 (I0 /I)
I0 =Πρόσπτωση φωτός-Ένταση φωτός πριν από το δείγμα
I =Μεταδιδόμενο φως – Ένταση φωτός μετά το δείγμα
Ο νόμος Beer-Lambert χρησιμοποιείται συνήθως στις μετρήσεις απορρόφησης και μετάδοσης σε δείγματα και μπορεί να χρησιμοποιηθεί για τον προσδιορισμό της συγκέντρωσης ενός δείγματος. Σε μια μέτρηση απορρόφησης, το φως διέρχεται μέσα από μια κυψελίδα γεμάτη με δείγμα. Η ένταση του φωτός μετά την κυβέτα συγκρίνεται με το φως πριν περάσει από την κυβέτα. Το μέγεθος της κυβέτας καθορίζει το μήκος διαδρομής (L). (Η κυβέτα είναι ένα ειδικό κομμάτι γυαλιού.) Όσο πιο φαρδιά είναι η κυβέτα, τόσο περισσότερο δείγμα θα περάσει το φως και τόσο χαμηλότερο θα είναι το εκπεμπόμενο φως. Αυτό εξηγεί γιατί η εξίσωση εξαρτάται από το μήκος διαδρομής (L).
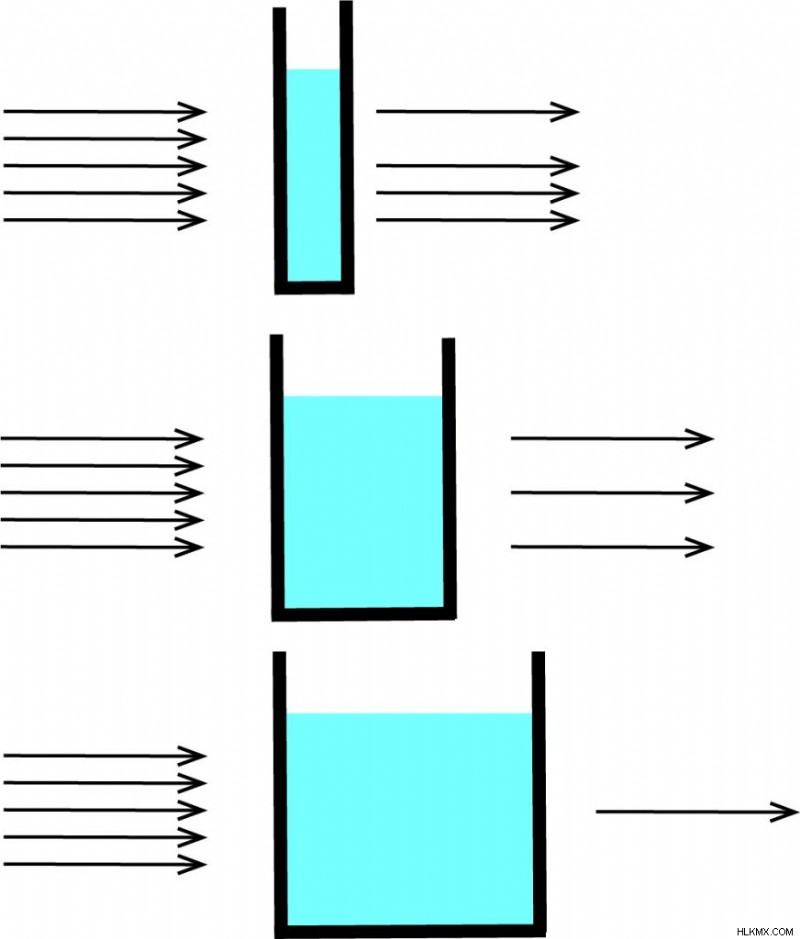
Τι είναι ο Μοριακός Συντελεστής Εξάλειψης;
Ο μοριακός συντελεστής εξάλειψης είναι συγκεκριμένος για κάθε χημική ουσία και μια σημαντική μεταβλητή στο νόμο Beer-Lambert. Ο μοριακός συντελεστής εξάλειψης μετρά πόσο φως απορροφά μια ουσία και είναι ειδικό για το μήκος κύματος. Επίσης μερικές φορές αναφέρεται ως μοριακός συντελεστής απορρόφησης ή μοριακή απορρόφηση. Στις εξισώσεις, τις περισσότερες φορές συμβολίζεται ως έψιλον, ϵ.
Οι μονάδες του μοριακού συντελεστή απόσβεσης είναι συνήθως Mcm. Οι μονάδες πρέπει να ταιριάζουν με τις μονάδες μήκους διαδρομής και συγκέντρωσης δείγματος. Με αυτόν τον τρόπο η απορρόφηση καταλήγει σε έναν αριθμό χωρίς μονάδα. Σε ένα γράφημα, η απορρόφηση γράφεται συχνά με μονάδες A.U., που σημαίνει αυθαίρετες μονάδες.
Γράφημα νόμου Beer-Lambert
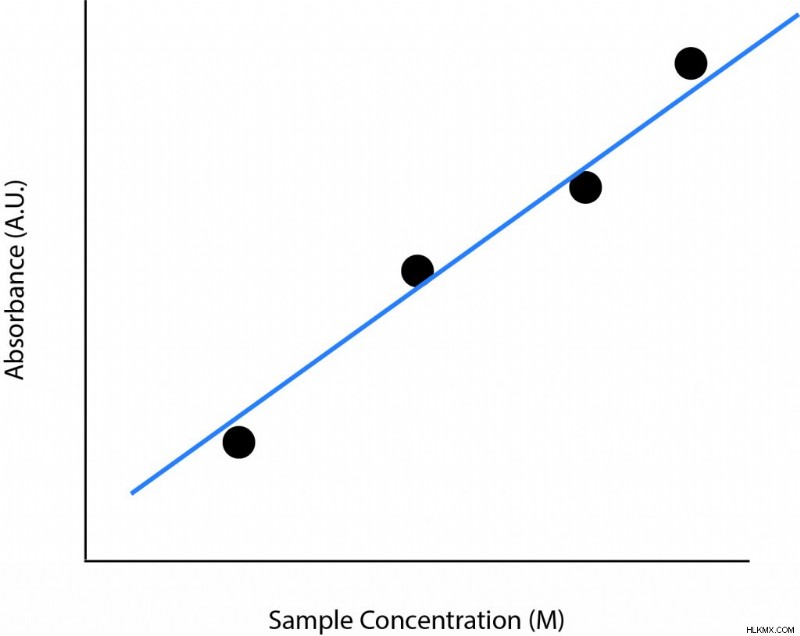
Ένα τυπικό γράφημα που απεικονίζει τον νόμο Beer-Lambert θα είναι γραμμικό και θετικά συσχετισμένο. Ο άξονας x θα έχει μονάδες συγκέντρωσης και ο άξονας y θα είναι απορρόφηση. Αυτό δείχνει ότι οι άλλες δύο μεταβλητές στην εξίσωση, ο συντελεστής μοριακής απόσβεσης και το μήκος διαδρομής, διατηρούνται σταθερές. Καθώς αυξάνεται η συγκέντρωση, αυξάνεται και η απορρόφηση. Αυτό το μοτίβο είναι λογικό γιατί αν η συγκέντρωση αυξηθεί, υπάρχουν περισσότερα μόρια που απορροφούν το φως και προκαλούν αύξηση της απορρόφησης.
Παρακάτω είναι ένα γράφημα παρόμοιο με αυτό που μπορεί να δείτε που δείχνει τον νόμο Beer-Lambert. Μετρώνται πολλές διαφορετικές συγκεντρώσεις. Στη συνέχεια, προσαρμόστε μια γραμμή σε αυτά τα σημεία. Η κλίση της γραμμής θα είναι το μήκος της διαδρομής επί τον μοριακό συντελεστή εξάλειψης. Εάν γνωρίζετε το μήκος της διαδρομής, ο μοριακός συντελεστής εξάλειψης μπορεί εύκολα να προσδιοριστεί. Ο μοριακός συντελεστής εξάλειψης θα είναι η κλίση της γραμμής διαιρούμενη με το μήκος διαδρομής.
Εφαρμογές του νόμου Beer-Lambert
Ο νόμος Beer-Lambert χρησιμοποιείται συνήθως για τον προσδιορισμό της συγκέντρωσης ενός δείγματος άγνωστης συγκέντρωσης, σημαντικό για πειράματα όπως η αντίδραση ρολογιού ιωδίου. Για να γίνει αυτό, πρώτα μετράται η απορρόφηση πολλαπλών δειγμάτων γνωστής συγκέντρωσης. Ένα φασματόμετρο κάνει αυτή τη μέτρηση. Αυτά τα σημεία ταιριάζουν σε μια γραμμή. Η γραμμή θα έχει μια κλίση του μοριακού συντελεστή απόσβεσης επί το μήκος της διαδρομής. Διαιρώντας αυτό με το μήκος της διαδρομής δίνεται ο μοριακός συντελεστής απόσβεσης. Στη συνέχεια μπορεί να μετρηθεί η απορρόφηση του άγνωστου δείγματος. Η απορρόφηση διαιρούμενη με το μήκος διαδρομής επί τον μοριακό συντελεστή εξάλειψης θα δώσει στη συνέχεια τη συγκέντρωση του δείγματος.
Περιορισμοί του νόμου
Ο νόμος τείνει να γίνεται ανακριβής σε υψηλές συγκεντρώσεις. Αυτό οφείλεται σε συνδυασμό διαφορετικών παραγόντων. Ο δείκτης διάθλασης του διαλύματος μπορεί να αποκλίνει. Υπάρχουν πιθανά φαινόμενα κορεσμού και συσσωμάτωσης λόγω της αλληλεπίδρασης του μορίου που μας ενδιαφέρει (όχι μόνο του διαλύτη όπως συμβαίνει σε χαμηλές συγκεντρώσεις). Ένας εξαιρετικός τρόπος για να ελέγξετε τους περιορισμούς του νόμου Beer-Lambert είναι να κάνετε μια γραφική παράσταση απορρόφησης στίχου συγκέντρωσης σε όλο και πιο υψηλές συγκεντρώσεις για ένα δείγμα. Το διάγραμμα πρέπει να είναι γραμμικό, αλλά σε υψηλές συγκεντρώσεις θα σταματήσει να είναι γραμμικό. Σε αυτό το σημείο, οι υψηλές συγκεντρώσεις κάνουν τον νόμο να είναι ανακριβής.
Ένας εξαιρετικός τρόπος για να ελέγξετε τους περιορισμούς του νόμου Beer-Lambert είναι να κάνετε μια γραφική παράσταση απορρόφησης στίχου συγκέντρωσης σε όλο και πιο υψηλές συγκεντρώσεις για ένα δείγμα. Το διάγραμμα πρέπει να είναι γραμμικό, αλλά σε υψηλές συγκεντρώσεις θα σταματήσει να είναι γραμμικό. Σε αυτό το σημείο, οι υψηλές συγκεντρώσεις κάνουν τον νόμο να είναι ανακριβής.
Παράδειγμα προβλημάτων
Παράδειγμα προβλήματος #1 :Έχετε ένα διάλυμα χρωστικής ροδαμίνης άγνωστης συγκέντρωσης. Χρησιμοποιώντας ένα φασματόμετρο μετράτε την απορρόφηση να είναι 9048. Γνωρίζετε ότι ο μοριακός συντελεστής εξαφάνισης της ροδαμίνης είναι 116000 cm M. Η κυψελίδα που χρησιμοποιήσατε έχει μήκος διαδρομής 1 cm. Ποια είναι η συγκέντρωση του δείγματός σας;
Παράδειγμα λύσης #2: Εδώ προσπαθούμε να προσδιορίσουμε την τιμή του C στον νόμο Beer-Lambert. Ξεκινάμε λοιπόν αναδιατάσσοντας την εξίσωση που θα λύσουμε για τη μεταβλητή που αναζητούμε
A =ϵLc
c =A / ϵL
Τότε μπορούμε να αρχίσουμε να συνδέουμε τιμές. Φροντίστε να προσέχετε τις μονάδες ώστε η συγκέντρωσή μας να βγαίνει με μονάδες μοριακότητας.
c =9048 / (1 cm * 116000 cm M )
c =9048 / 116000 M
0,078 M =γ
Η συγκέντρωση του άγνωστου διαλύματος είναι 0,078 M.




