Λειτουργική ομάδα εποξειδίου
Βασικές έννοιες
Σε αυτό το σεμινάριο οργανικής χημείας, μαθαίνουμε για τη λειτουργική ομάδα του εποξειδίου, συμπεριλαμβανομένου του ορισμού, των βασικών ιδιοτήτων, των συμβάσεων ονομασίας και των σημαντικών αντιδράσεων.
Τι είναι το εποξείδιο;
Ένα εποξείδιο είναι μια μοναδική λειτουργική ομάδα που βρίσκεται σε πολλές οργανικές ενώσεις. Η ομάδα περιλαμβάνει δύο άνθρακες και οξυγόνο που σχηματίζουν μια τριμελή δομή δακτυλίου.
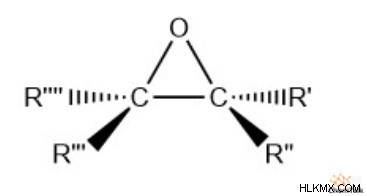
Λόγω της φύσης των τριμελών δομών δακτυλίων, τα εποξείδια τείνουν να έχουν μικρή σταθερότητα. Ωστόσο, έχουν σημαντική χρήση ως ενδιάμεσο αντίδρασης σε πολλά σημαντικά μονοπάτια οργανικής σύνθεσης.
Γρήγορες πληροφορίες για τα εποξείδια
- Δομή:μια τριμελής δομή δακτυλίου από δύο άνθρακες και ένα οξυγόνο
- Γενικός τύπος:COC
- Οξύτητα:Πολύ όξινη (pKa =-3) όταν είναι σε πρωτονιωμένη μορφή
- Διαλυτότητα:Μέτρια διαλυτό στο νερό και άλλους πολικούς διαλύτες
- Μήκος δεσμού C-O:1,47Å
- Ενθαλπία δεσμού C-O:350 kJ mol
- Φασματοσκοπία υπερύθρων:Τα εποξείδια τείνουν να εμφανίζουν δύο ισχυρές κορυφές στα 750-880 και 810-950 cm
Εποξείδιο Συμβάσεις ονομασίας
Όπως βλέπουμε στην επόμενη ενότητα, τα περισσότερα εποξείδια σχηματίζονται ως παράγωγα αλκενίων ή κάποιων άλλων ειδών με δεσμό π. Έτσι, οι περισσότερες συμβάσεις ονομασίας εποξειδίου περιλαμβάνουν αναφορά στο μητρικό αλκένιο.
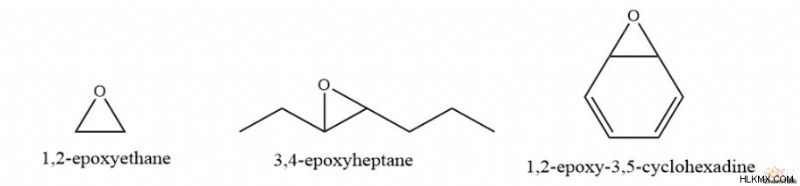
Για παράδειγμα, οι συμβάσεις της IUPAC περιλαμβάνουν την αναφορά των αριθμών των δύο εμπλεκόμενων ανθράκων με το επίθημα «εποξύ-». Έτσι, το απλούστερο εποξείδιο, το C2 H4 O, έχει την ονομασία IUPAC 1,2-εποξυαιθάνιο. Άλλα παραδείγματα περιλαμβάνουν το 3,4-εποξυεπτάνιο, με μια εποξειδική ομάδα μεταξύ των ανθράκων 4 και 5, και το 1,2-εποξυ-3,5-κυκλοεξαδιένιο.
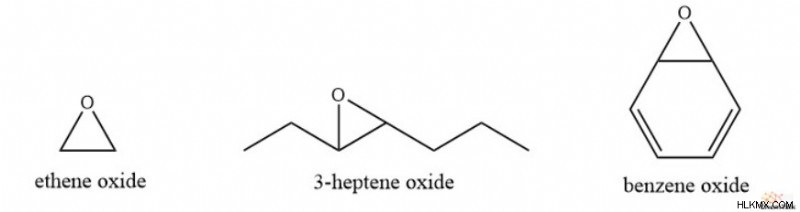
Μια άλλη κοινή σύμβαση ονομασίας εποξειδίου περιλαμβάνει την απλή ονομασία του μητρικού αλκενίου ακολουθούμενη από τον όρο οξείδιο. Έτσι, το 1,2-εποξυαιθάνιο γίνεται οξείδιο του αιθενίου, το 3,4-εποξυεπτάνιο γίνεται οξείδιο 3-επτενίου και το 1,2-εποξυ-3,5-κυκλοεξαδιένιο γίνεται οξείδιο του βενζολίου.
Αντιδράσεις σύνθεσης εποξειδίου
Όπως διερευνούμε στην επόμενη ενότητα, πολλές συνθετικά σημαντικές αντιδράσεις μπορούν να συμβούν με τα εποξείδια. Ως αποτέλεσμα, οι οργανικοί χημικοί έχουν αναπτύξει πολλές τεχνικές για τον σχηματισμό εποξειδίων από άλλες, λιγότερο συνθετικά χρήσιμες ομάδες.
Οξείδωση αιθενίου
Για να παραχθεί οξείδιο του αιθενίου, πρέπει απλώς να αντιδράσει το αιθένιο με το διατομικό οξυγόνο. Είναι σημαντικό ότι οι χημικοί χρησιμοποιούν έναν καταλύτη αργύρου-αλουμινίου για να διεγείρουν την αντίδραση. Στοιχειομετρικά, δύο αιθένια αντιδρούν ανά ένα μόριο αερίου οξυγόνου. Ωστόσο, για κάθε έξι μόρια οξειδίου του αιθενίου, αυτή η αντίδραση οξειδώνει πλήρως ένα αιθένιο πλήρως σε διοξείδιο του άνθρακα.
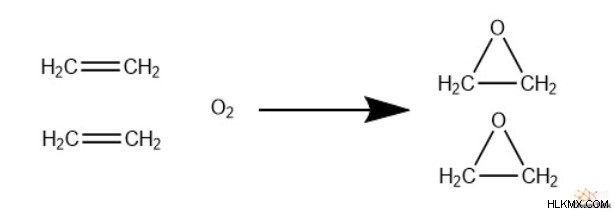
Δυστυχώς, τα μεγαλύτερα αλκένια δεν μπορούν να οξειδωθούν σε εποξείδια μέσω αυτού του μηχανισμού, καθώς αυτά τα αλκένια έχουν πολύ μικρότερη αντιδραστικότητα.
Αντίδραση με υπεροξείδια
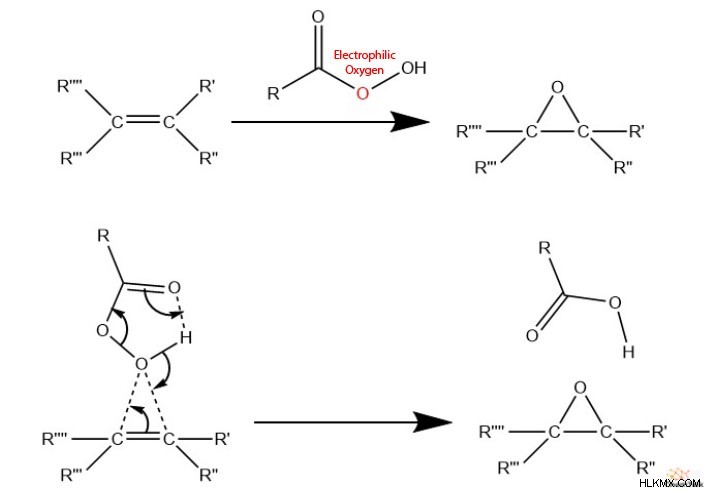
Ένας άλλος, πιο γενικός τρόπος σύνθεσης εποξειδίων περιλαμβάνει την αντίδραση αλκενίων με ένα υπεροξυκαρβοξυλικό οξύ, επίσης γνωστό ως υπεροξυοξύ. Οι χημικοί συχνά αποκαλούν αυτή την αντίδραση «υπεροξείδωση ολεφίνης», με την «ολεφίνη» να χρησιμεύει ως εναλλακτικός όρος για ένα αλκένιο. Αυτές οι ομάδες υπεροξειδίου περιλαμβάνουν ένα ηλεκτρόφιλο είδος οξυγόνου που μπορεί να προσβληθεί από τα ηλεκτρόνια π του αλκενίου. Περαιτέρω, τα υπεροξυκαρβοξυλικά οξέα έχουν επίσης μια καρβονυλική ομάδα η οποία μπορεί να δράσει ως δέκτης πρωτονίων.
Αυτή η αντίδραση προχωρά μέσω του «Μηχανισμού της πεταλούδας», ο οποίος περιλαμβάνει τη συντονισμένη κίνηση οκτώ ηλεκτρονίων, με αποτέλεσμα ένα εποξείδιο.
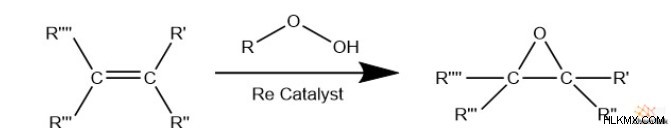
Τα αλκένια μπορούν επίσης να αντιδράσουν με γενικά υπεροξείδια (R-OOH) για να δώσουν εποξείδια. Ωστόσο, αυτή η αντίδραση απαιτεί έναν μεταλλικό καταλύτη, παρόμοιο με την οξείδωση του αιθενίου. Οι χημικοί συχνά αναφέρονται σε αυτή την αντίδραση με υπεροξείδια ως «οξείδωση ολεφινών».
Ενδομοριακό SN 2
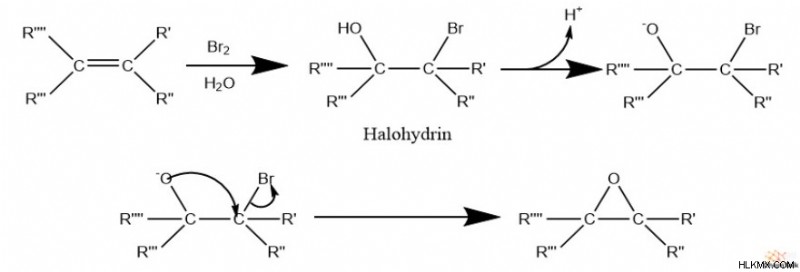
Επιπλέον, τα εποξείδια μπορούν να σχηματιστούν ως αποτέλεσμα μιας ομάδας οξειδίου που χρησιμεύει ως πυρηνόφιλο σε ένα ενδομοριακό SN 2 αντίδραση. Συγκεκριμένα, αυτό περιλαμβάνει το σχηματισμό μιας ομάδας αλοϋδρίνης, η οποία περιέχει μια αλκοόλη δίπλα σε μια ομάδα αλογονιδίου.
Στη συνέχεια, εάν η αλοϋδρίνη υπάρχει σε βασικές συνθήκες, η αλκοόλη αποπρωτονιώνεται, σχηματίζοντας ένα οξείδιο. Τέλος, το οξείδιο επιτίθεται στον άνθρακα με το αλογονίδιο, το οποίο γίνεται μια αποχωρούσα ομάδα καθώς σχηματίζεται το εποξείδιο. Αυτή η αντίδραση μπορεί να θεωρηθεί ως μια ενδομοριακή σύνθεση αιθέρα Williamson.
Αντιδράσεις με εποξείδια
Πυρηνόφιλη προσθήκη
Λόγω του στελέχους δακτυλίου της τριμελούς δομής του εποξειδίου, οι χημικοί συχνά κάνουν εύκολη χρήση πυρηνόφιλων αντιδραστηρίων για το άνοιγμα του δακτυλίου. Συγκεκριμένα, το πυρηνόφιλο επιτίθεται σε έναν από τους άνθρακες που διασπά τον δεσμό αυτού του άνθρακα με το οξυγόνο που χρησιμεύει ως «αναχωρούσα ομάδα» σε μια οιονεί πυρηνόφιλη υποκατάσταση. Το τελικό προϊόν περιλαμβάνει μια ομάδα αλκοόλης ή οξειδίου που συνδέεται με τον άνθρακα που δεν έχει προσβληθεί.
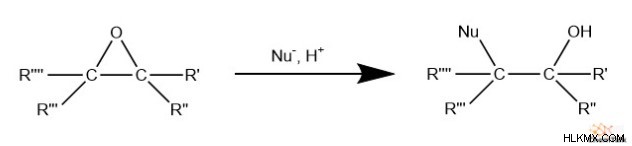
Είναι ενδιαφέρον ότι εάν οι άνθρακες του εποξειδίου έχουν διαφορετικούς υποκαταστάτες, αυτή η αντίδραση μπορεί να είναι τοποεκλεκτική ανάλογα με το pH του μίγματος της αντίδρασης. Εάν η πυρηνόφιλη προσθήκη λάβει χώρα υπό βασικές συνθήκες, το πυρηνόφιλο επιτίθεται στον λιγότερο υποκατεστημένο άνθρακα, λόγω στερικής παρεμπόδισης.
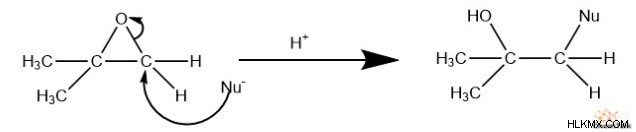
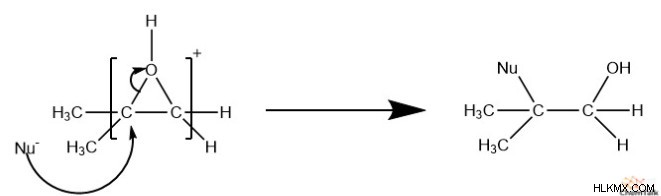
Ωστόσο, εάν η αντίδραση συμβεί υπό όξινες συνθήκες, ο περισσότερο υποκατεστημένος άνθρακας είναι πιο πιθανό να αντιδράσει με το πυρηνόφιλο. Αυτό συμβαίνει επειδή το εποξείδιο πρωτονιώνεται πριν από την αντίδραση. Ως αποτέλεσμα, αυτό τοποθετεί ένα μερικό θετικό φορτίο στους άνθρακες του εποξειδίου. Όπως γνωρίζουμε από τη μελέτη του SN 1 αντιδράσεις, περισσότερο υποκατεστημένοι άνθρακες σχηματίζουν πιο σταθερά κατιόντα. Αυτό αποδυναμώνει τον δεσμό μεταξύ του οξυγόνου και του περισσότερο υποκατεστημένου άνθρακα, καθιστώντας ευκολότερο το σπάσιμο.
Πολυμερισμός
Μόλις ανοίξει ο δακτύλιος εποξειδίου, η αλκοόλη που προκύπτει μπορεί να χρησιμεύσει ως αποτελεσματικό πυρηνόφιλο σε ένα επόμενο άνοιγμα δακτυλίου εποξειδίου. Ως αποτέλεσμα, τα εποξείδια πολυμερίζονται εύκολα σε πολυαιθερικές δομές.
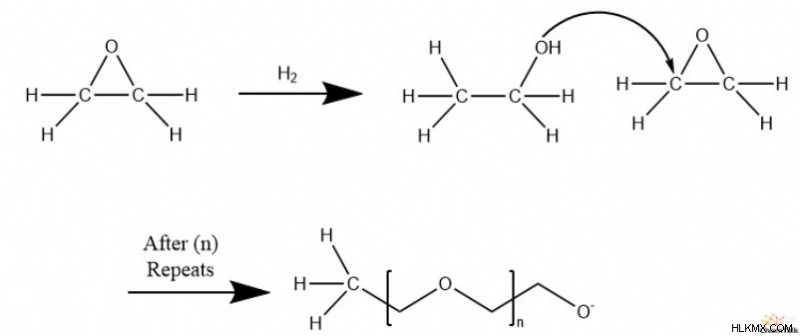
Συχνά, για να καταλυθεί ο πολυμερισμός, στην αντίδραση συμμετέχει μια ένωση αλκοόλης. Το αποτέλεσμα είναι ότι μια αλκοόλη και η ομάδα R της ένωσης καλύπτουν την αλυσίδα πολυαιθέρα.
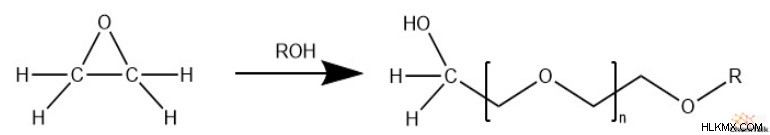
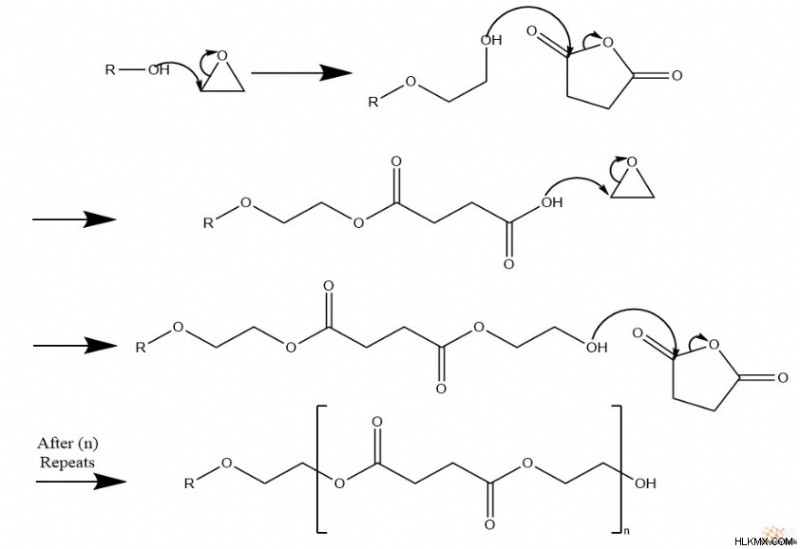
Επιπλέον, όταν υπάρχουν είδη ανυδρίτη στο μείγμα αντίδρασης, αυτή η αντίδραση πολυμερισμού δημιουργεί πολυεστερικές αλυσίδες.
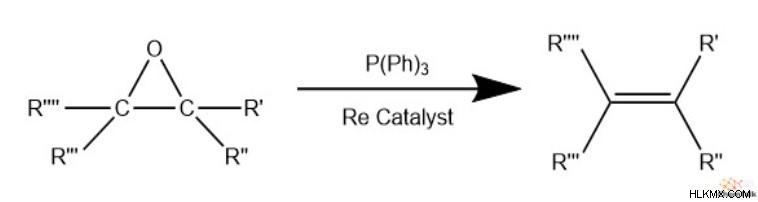
Αναγωγή σε αλκένιο
Εκτός από τις αντιδράσεις ανοίγματος δακτυλίου, οι χημικοί μπορούν επίσης να μειώσουν τα εποξείδια πίσω σε αλκένια. Αυτό συχνά περιλαμβάνει έναν καταλύτη βαρέων μετάλλων, όπως το βολφράμιο ή το ρήνιο, καθώς και ένα αναγωγικό, όπως το αέριο υδρογόνο (H2 ), φωσφορικό τριφαινυλεστέρα (P(Ph)3 ), ή θειώδες νάτριο (Na2 SO3 ).