Υβριδισμός πενταφθοριούχου βρωμίου
Τα αλογόνα είναι τα στοιχεία που ανήκουν στην Ομάδα 7 του περιοδικού πίνακα. Η οικογένεια αλογόνου περιλαμβάνει φθόριο, χλώριο, βρώμιο, ιώδιο, αστατίνη και τεννεσίνη. Τα αλογόνα έχουν σθένος 1 λόγω του ελεύθερου χώρου για να δέχονται ηλεκτρόνια. Είναι εξαιρετικά ηλεκτραρνητικά λόγω της κενού θέσης στο εξωτερικό κέλυφος. Τα αλογόνα τείνουν να αντιδρούν μέσα τους για να σχηματίσουν ενώσεις διαλογόνων με ομοιοπολικούς δεσμούς ανάμεσά τους.
Μια τέτοια ένωση είναι το πενταφθοριούχο βρώμιο. Ο υβριδισμός του πενταφθοριούχου βρωμίου σχηματίζει ένα υβριδικό τροχιακό διαφορετικής ενέργειας και ποικίλου σχήματος, όπως κάθε άλλη διαδικασία υβριδισμού ατόμων.
Υβριδισμός:Τι σημαίνει;
Υβριδισμός σημαίνει γενικά την ανάμειξη δύο πραγμάτων, που οδηγεί σε ένα νέο προϊόν που ονομάζεται υβρίδιο.
Στη χημεία, ο υβριδισμός αναφέρεται στην ιδέα των τροχιακών δύο ατόμων που αναμιγνύονται για να σχηματίσουν ένα νέο τροχιακό που έχει διαφορετική ενέργεια, σχήμα και ιδιότητες από τα μητρικά στοιχεία.
Αλογόνα
Τα αλογόνα παίρνουν τη θέση τους στον περιοδικό πίνακα στην ομάδα 7. Το όνομά τους αναφέρεται στην ιδιότητά τους να σχηματίζουν άλατα. Η οικογένεια αλογόνου περιλαμβάνει F, Cl, Br, I, At και ίσως Ts.
Ιδιότητες αλογόνων
Τα αλογόνα έχουν κάποιες κοινές και γενικές φυσικές και χημικές ιδιότητες. Συνήθως υπάρχουν ως ομοπυρηνικό διάτομο.
Μέγεθος
Το πρώτο αλογόνο, το φθόριο, με ατομικό αριθμό 9 της ομάδας, έχει 2 τροχιές στο άτομό του της ηλεκτρονικής διαμόρφωσης 2,7.
Μια επιπλέον τροχιά προστίθεται στο άτομο όταν μετακινείται προς τα κάτω στην ομάδα.
Έτσι, το μέγεθος ενός αλογόνου αυξάνεται στην ομάδα.
Σθένος
Όλα τα αλογόνα διαθέτουν ελεύθερο χώρο για την προσθήκη ενός ηλεκτρονίου στη στιβάδα σθένους.
Έτσι, το σθένος των αλογόνων είναι πάντα 1.
Ηλεκτραρνητικότητα
Λόγω της ικανότητας να προσλαμβάνουν ένα ηλεκτρόνιο στο φλοιό σθένους τους, ενεργούν ηλεκτραρνητικά.
Η ιδιότητα ηλεκτραρνητικότητας τους τείνει να μειώνει την ομάδα λόγω του αυξημένου μεγέθους τους όταν κινούνται προς τα κάτω.
Πενταφθοριούχο βρώμιο
Το πενταφθοριούχο βρώμιο, BrF5, είναι μια διαλογονική ένωση που σχηματίζεται λόγω ενός πεντασθενούς ατόμου βρωμίου. Το μόριο είναι εξαιρετικά αντιδραστικό και σε μορφή ατμού, ερεθίζοντας το δέρμα, τα μάτια και τη βλεννογόνο μεμβράνη μας.
Ηλεκτρονική διαμόρφωση βρωμίου
Ο ατομικός αριθμός του βρωμίου είναι 35.
Έχει ηλεκτρονική διαμόρφωση [Ar]4s23d104p5.
Ηλεκτρονική διαμόρφωση φθορίου
Ο ατομικός αριθμός του φθορίου είναι 9.
Έχει ηλεκτρονική διαμόρφωση [He]2s22p5.
Ένα άτομο φθορίου μπορεί να δεχτεί ένα ζεύγος ηλεκτρονίων από το άτομο βρωμίου όταν χάσει ένα ζεύγος ηλεκτρονίων από τη στιβάδα σθένους.
Έτσι, πέντε άτομα φθορίου συνδέονται με το πεντασθενές άτομο βρωμίου, με αποτέλεσμα ένα υβριδοποιημένο μόριο πενταφθοριούχου βρωμίου.
Ηλεκτρόνια στα τροχιακά
Ένα τροχιακό είναι ένας τρισδιάστατος χώρος όπου τα ηλεκτρόνια βρίσκονται κυρίως σε ένα άτομο. Ένα τροχιακό μπορεί, γενικά, να κρατήσει δύο ηλεκτρόνια.
Το τροχιακό s είναι ικανό να συγκρατεί 2 ηλεκτρόνια.
Το τροχιακό p μπορεί να χωρέσει 6 ηλεκτρόνια επειδή χωρίζεται σε px, py και pz, το καθένα από τα οποία περιέχει δύο ηλεκτρόνια.
Το τροχιακό d μπορεί να χωρέσει έως και 10 ηλεκτρόνια, καθώς υποδιαιρείται σε dxy, dyz, dxz, dx2-y2 και dz2.
Κάθε τροχιακό περιέχει δύο ηλεκτρόνια. Έτσι, συνολικά, ένα d τροχιακό χωρά έως και 10 ηλεκτρόνια.
Ένα τροχιακό f είναι ικανό να συγκρατεί 14 ηλεκτρόνια.
Υβριδισμός πενταφθοριούχου βρωμίου
Ο υβριδισμός του πενταφθοριούχου βρωμίου οδηγεί σε μια τροχιακή διαμόρφωση του sp3d2.
Ο υβριδισμός έχει ως αποτέλεσμα ένα τετράγωνο πυραμιδικό σχήμα του μορίου.
Γενικά η ηλεκτρονική διαμόρφωση βρωμίου είναι 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5.
Όμως, για να επιτευχθεί μια πεντασθενής δομή, το άτομο πρέπει να έχει πέντε ελεύθερα ηλεκτρόνια.
Έτσι, τρία ηλεκτρόνια από το 4p5 μετατοπίζονται στο 4d τροχιακό, με αποτέλεσμα πέντε ζεύγη ηλεκτρονίων μεμονωμένα.
Η μετατόπιση ευνοεί μια μισογεμάτη διαμόρφωση τροχιακού 4p, καθιστώντας την πιο σταθερή.
Γεμίζει επίσης ένα από τα πέντε τροχιακά του 4d τροχιακού.
Έτσι, πέντε άτομα φθορίου μπορούν να δεχτούν ένα μόνο ζεύγος ηλεκτρονίων συνδεδεμένο με το άτομο βρωμίου.
Έτσι, τα τροχιακά τους αναμειγνύονται μέσω υβριδισμού, σχηματίζοντας το υβριδικό σχήμα του μορίου.
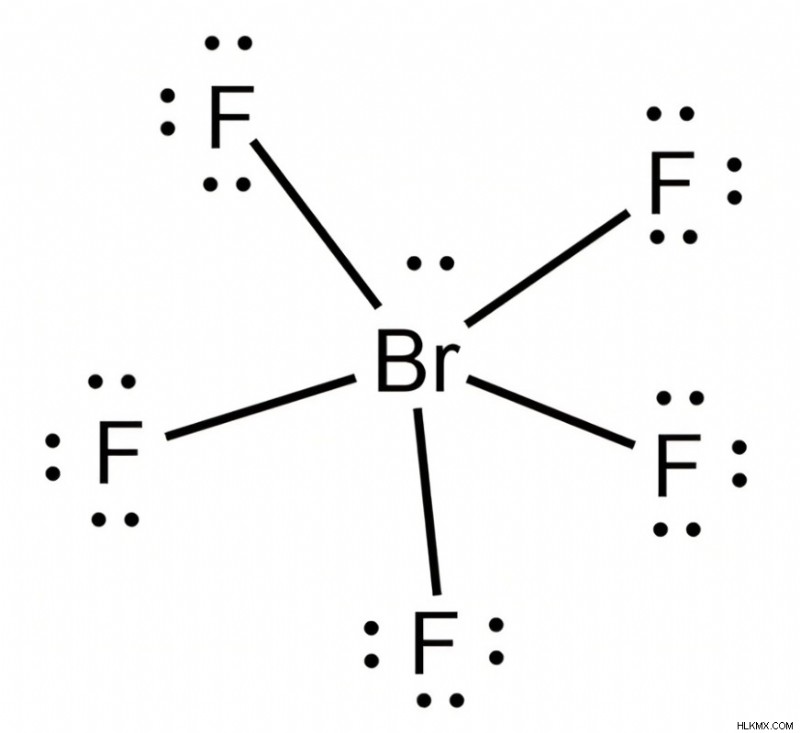
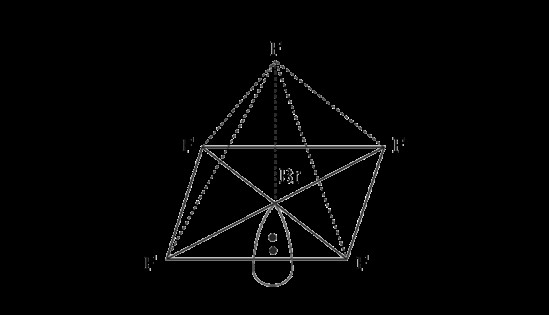
Πενταφθοριούχο βρώμιο – τετράγωνη πυραμιδική δομή
Σε αλληλεπικαλυπτόμενες πλευρές, το πενταφθοριούχο βρώμιο σχηματίζει δεσμούς βρωμίου πέντε σίγμα με φθόριο.
Στην τετράγωνη πυραμιδική δομή που σχηματίζεται λόγω του υβριδισμού του πενταφθοριούχου φθορίου, η γωνία του δεσμού που σχηματίζεται μεταξύ των ατόμων φθορίου με το κεντρικό άτομο είναι 90°.
Υπάρχει ακόμη ένα μόνο ζεύγος ηλεκτρονίων στο κεντρικό άτομο βρωμίου.
Εφαρμογές πενταφθοριούχου βρωμίου
Το πενταφθοριούχο βρώμιο είναι ένα άχρωμο υγρό που αναδίδει μια έντονη οσμή.
Γενικά δρα ως οξειδωτικός παράγοντας στα προωθητικά πυραύλων.
Συμμετέχει ως ένας από τους οξειδωτικούς παράγοντες στη μετατροπή του ουρανίου σε εξαφθοριούχο ουράνιο.
Βοηθά στη σύνθεση φθορανθράκων.
Συμπέρασμα
Ο υβριδισμός των νότων Bromine Pentafluoride παρέχει όλες τις λεπτομέρειες για το χημικό μόριο πενταφθοριούχο βρώμιο. Είναι ένα υβριδικό μόριο που σχηματίζεται λόγω ομοιοπολικού δεσμού μεταξύ του πεντασθενούς βρωμίου και πέντε ατόμων φθορίου, χωρίς ένα ζεύγος ηλεκτρονίων. Είναι εξαιρετικά αντιδραστικό και χρησιμοποιείται σε χημικές διεργασίες και εμπορικά προωθητικά πυραύλων ως οξειδωτικά.
Ο υβριδισμός του πενταφθοριούχου βρωμίου σχηματίζει έναν υβριδισμό sp3d2, με αποτέλεσμα μια τετράγωνη πυραμιδική μοριακή δομή. Το υβριδικό μόριο έχει έξι δεσμούς σίγμα λόγω του ομοιοπολικού μοιρασμού ηλεκτρονίων και μια γωνία δεσμού περίπου 90°. Για να συμβεί ο υβριδισμός, δύο ηλεκτρόνια από το τροχιακό 4p του βρωμίου μετατοπίζονται στο τροχιακό του 4d.