Γεγονότα για τον Φώσφορο 1
Ο φώσφορος είναι το 15 στοιχείο του περιοδικού πίνακα. Αυτά τα στοιχεία φωσφόρου περιέχουν χημικά και φυσικά δεδομένα μαζί με γενικές πληροφορίες και ιστορικό.

Βασικά στοιχεία για τον φώσφορο
Όνομα: Φώσφορος
Ατομικός αριθμός: 15
Σύμβολο στοιχείου: P
Ομάδα: 15
Περίοδος: 3
Αποκλεισμός: p
Οικογένεια στοιχείων: Μη μέταλλο
Ατομική μάζα: 30.973 761 998(5)
Διαμόρφωση ηλεκτρονίου: [Ne]3s3p (συντομογραφία) ή 1s2s2p3s3p (πλήρη)
Ανακάλυψη: Hennig Brand το 1669.
Ο Γερμανός αλχημιστής Hennig Brand απομόνωσε τον φώσφορο από τα ούρα. Αρχικά ονόμασε την ουσία του «κρύα φωτιά» επειδή έλαμπε στο σκοτάδι.
Προέλευση ονόματος: Ο φώσφορος ονομάστηκε από την ελληνική λέξη φώσφορος που σημαίνει «φέρον φως».
Ισότοπα:
Ο φυσικός φώσφορος αποτελείται από ένα σταθερό ισότοπο:P. Υπάρχουν είκοσι δύο ραδιενεργά ισότοπα που κυμαίνονται από P έως P.
Π
Ο φωσφόρος-30 είναι ένα σταθερό ισότοπο που περιέχει 16 νετρόνια. Το 100% του φυσικού φωσφόρου είναι φώσφορος-31.
Π
Ο φωσφόρος-32 είναι ένα ραδιενεργό ισότοπο που περιέχει 17 νετρόνια. Ο φώσφορος-32 διασπάται με β- διάσπαση σε S με χρόνο ημιζωής 14.263 ημέρες. Αυτό το ισότοπο χρησιμοποιείται από βιολόγους για την επισήμανση των αλλαγών του DNA και του RNA.

Φυσικά δεδομένα
Ο φώσφορος έχει τέσσερα αλλότροπα:λευκό, κόκκινο, ιώδες και μαύρο.
Πυκνότητα: λευκό:1,823 g/cm κόκκινο:2,3 g/cm βιολετί:2,36 g/cm λευκό:1,823 g/cm
Σημείο τήξης: 317,3 K(44,15°C, 111,47°F)
Σημείο βρασμού: 553,7 K(280,5°C, 536,9°F)
Κατάσταση στους 20ºC: Στερεά
Heat of Fusion: 0,66 kJ/mol
Θερμότητα εξάτμισης: 51,9 kJ/mol
Μοριακή θερμική χωρητικότητα: 23.824 J/mol·K
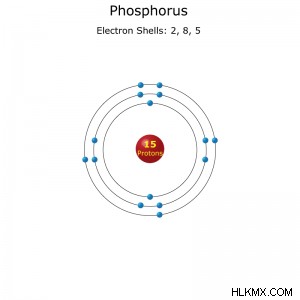
Ατομικά δεδομένα
Ατομική ακτίνα: 1,80 Å
Ομοιοπολική ακτίνα: 1,07 Å
Ακτίνα Van der Waals: 1,80 Å
Συγγένεια ηλεκτρονίων: 72,037 kJ/mol
Ηλεκτραρνητικότητα: 2.19
1 Ενέργεια Ιονισμού: 1011,812 kJ/mol
2 Ενέργεια Ιονισμού: 1907,467 kJ/mol
3 Ενέργεια Ιονισμού: 2914,118 kJ/mol
4 Ενέργεια Ιονισμού: 4963.582 kJ/mol
5 Ενέργεια Ιονισμού: 6273,969 kJ/mol
6 Ενέργεια Ιονισμού: 21267.395 kJ/mol
7 Ενέργεια Ιονισμού: 25430,64 kJ/mol
8 Ενέργεια Ιονισμού: 29871,9 kJ/mol
Καταστάσεις οξείδωσης: +5, -3 (κοινό), +4, +3, +2, +1, -1, -2 (ασυνήθιστο)
Διασκεδαστικά στοιχεία για τον φώσφορο
- Ο φώσφορος είναι εξαιρετικά δραστικός. Δεν βρίσκεται ελεύθερο στη φύση.
- Ο λευκός φώσφορος είναι ένα κηρώδες στερεό και πολύ δηλητηριώδες. Η θανατηφόρα δόση είναι περίπου 50 mg.
- Ο λευκός φώσφορος λάμπει στο σκοτάδι και μπορεί να καεί αυθόρμητα στον αέρα.
- Ο κόκκινος φώσφορος βρίσκεται στο πλάι των σπιρτόκουτων. Ο κόκκινος φώσφορος σχηματίζεται όταν ο λευκός φώσφορος θερμαίνεται στους 250 ºC και σχηματίζει ατμό. Στη συνέχεια, ο ατμός συλλέγεται κάτω από το νερό.
- Ο φώσφορος είναι απαραίτητος για τη ζωή. Φωσφορικά άλατα (PO4 ιόντα) αποτελούν κύριο μέρος κάθε μορίου DNA και RNA. Είναι το P στο ADP και το ATP, τα μόρια που είναι υπεύθυνα για τη μεταφορά ενέργειας στο κύτταρο.
- Ο φώσφορος βρίσκεται στα οστά. Η στάχτη από τα οστά ήταν μια πρώιμη πηγή φωσφόρου.
- Ο δεύτερος από τους τρεις αριθμούς στο λίπασμα σχετίζεται με τον φώσφορο.
- Ο φώσφορος είναι το έκτο πιο κοινό στοιχείο στο ανθρώπινο σώμα.
- Ο φώσφορος είναι το έβδομο πιο κοινό στοιχείο στον φλοιό της Γης.
- Τα πρώτα σπίρτα χρησιμοποιούσαν λευκό φώσφορο στην κεφαλή του σπίρτου. Οι εργάτες σε εργοστάσια σπίρτων εκτέθηκαν υπερβολικά στον φώσφορο και ανέπτυξαν μια επώδυνη, εξουθενωτική παραμόρφωση του οστού της γνάθου, γνωστή ως «φωστική γνάθο»
- Τα σύνορα μεταξύ Βολιβίας και Χιλής άλλαξαν λόγω του φωσφόρου. Η Χιλή και το Περού μπήκαν σε πόλεμο με τη Βολιβία για την πρόσβαση σε προσοδοφόρα νησιά γκουάνο στα ανοικτά των ακτών. Το γκουάνο είναι πλούσιο σε άζωτο και φωσφορικά άλατα και το 1879, μια ζωτική πηγή και των δύο στοιχείων. Τελικά, η Βολιβία έχασε τη γη που τη συνέδεε με τον Ειρηνικό Ωκεανό.
- Η υπερβολική χρήση φωσφόρου και φωσφορικών αλάτων στο περιβάλλον προκαλεί την άνθιση των φυκιών σε ποτάμια και λίμνες. Τα πλεονάζοντα φύκια καταναλώνουν όλο το διαλυμένο οξυγόνο στο νερό και τα ψάρια (και τα φύκια) πεθαίνουν.
- Η διαδικασία του Hennig Brand να πάρει φώσφορο από τα ούρα ήταν ένα μυστικό. Επέλεξε να πουλήσει τη διαδικασία του σε άλλους αλχημιστές. Αυτή η διαδικασία έγινε ευρύτερα γνωστή όταν πουλήθηκε στη Γαλλική Ακαδημία Επιστημών το 1737.
Μάθετε περισσότερα σχετικά με τα στοιχεία στον περιοδικό πίνακα.




