Φασματική Ανάλυση Οργανικών Ενώσεων
Βασικές έννοιες
Σε αυτό το σεμινάριο οργανικής χημείας, διερευνούμε πώς να χρησιμοποιήσουμε τεχνικές φασματικής ανάλυσης IR και NMR για τον εντοπισμό άγνωστων ενώσεων. Θα εξερευνήσουμε εν συντομία κάθε τεχνική πριν προχωρήσουμε στη διαδικασία ανάλυσης χρησιμοποιώντας ένα παράδειγμα.
Κατανόηση της Οργανικής Δομής
Μία από τις πιο σημαντικές δεξιότητες που μπορεί να έχει ένας χημικός είναι να αναγνωρίζει μια άγνωστη ουσία. Με μια οργανική ουσία, οποιαδήποτε αναλυτική μέθοδος συνήθως δίνει μόνο μερικές δομικές λεπτομέρειες για το άγνωστο. Ως αποτέλεσμα, ένας οργανικός χημικός χρειάζεται συχνά να εκτελέσει πολλαπλές αναλύσεις πριν μπορέσει να κάνει μια ταυτοποίηση. Η ανάλυση κορεσμού σε συνδυασμό με φασματοσκοπία IR και NMR είναι μια ομάδα αναλυτικών τεχνικών που επιτρέπει την ταυτοποίηση πολλαπλών κοινών οργανικών ενώσεων.
Ας ρίξουμε μια σύντομη ματιά στο πώς λειτουργεί καθεμία από αυτές τις τρεις μεθόδους. Στη συνέχεια, ας δούμε πώς συνεργάζονται σε ένα παράδειγμα προβλήματος.
Προφασματική Ανάλυση:Βαθμοί Ακορεσμού
Για να εκτελέσετε ανάλυση κορεσμού και να υπολογίσετε τους βαθμούς ακορεστότητας, πρέπει να γνωρίζετε τον μοριακό τύπο του αγνώστου σας. Υπάρχουν πολλοί τρόποι με τους οποίους μπορείτε να το ανακαλύψετε χωρίς να γνωρίζετε την πλήρη δομή. Τέτοιες μέθοδοι περιλαμβάνουν φασματοσκοπία μάζας, ανάλυση καύσης εάν είναι εύφλεκτο, ανάλυση υποπροϊόντων με στοιχειομετρία και μερικές άλλες.
Με τον χημικό τύπο, μπορείτε να υπολογίσετε τους βαθμούς ακόρεστου της ένωσης χρησιμοποιώντας την αναλογία κάθε συστατικού. Συγκεκριμένα, χρησιμοποιείτε τον ακόλουθο τύπο:
Βαθμοί Ακορεσμού =(2(C) + 2 – (H + X – N))/2
C =Αριθμός ανθράκων στον τύπο
H =Αριθμός υδρογόνων στον τύπο
X =Αριθμός αλογόνων στον τύπο
N =Αριθμός αζώτων στον τύπο
Για να μάθετε περισσότερα σχετικά με τον τρόπο λειτουργίας του τύπου, ανατρέξτε σε αυτό το άρθρο, το οποίο παρέχει μια βαθύτερη εξήγηση.
Οι βαθμοί ακορέστου μιας ένωσης θα είναι πάντα ένας ακέραιος, ο οποίος ισούται με το άθροισμα των δεσμών pi και των δομών δακτυλίου που υπάρχουν. Για παράδειγμα, εάν χρησιμοποιήσετε τον παραπάνω τύπο με κυκλοπενταδιένιο (C5 H6 ), θα υπολογίσετε 3 βαθμούς ακόρεστου. Κατά συνέπεια, το κυκλοπενταδιένιο έχει 1 δομή δακτυλίου και 2 δεσμούς pi.
Γνωρίζοντας τους άγνωστους βαθμούς ακορέστου μας παρέχει μια σημαντική ένδειξη που βοηθά στην περαιτέρω ανάλυσή μας.
Φασματική Ανάλυση Ι:Φασματοσκοπία IR
Στη συνέχεια, μπορούμε να χρησιμοποιήσουμε τη φασματική ανάλυση IR για να προσδιορίσουμε περαιτέρω συγκεκριμένες λειτουργικές ομάδες που υπάρχουν στο άγνωστό μας. Με βάση τη γεωμετρία και τη χημεία του αγνώστου, οι χημικοί δεσμοί του δονούνται ο καθένας σε συγκεκριμένες συχνότητες. Η θεωρία υπερύθρων δηλώνει ότι μια μοριακή δομή απορροφά την υπέρυθρη ακτινοβολία μόνο σε συχνότητες που συντονίζονται με αυτές των δονήσεων του δεσμού της. Ένα φασματόμετρο IR μπορεί να πάρει αυτές τις απορροφήσεις, παρέχοντας κάθε συχνότητα συντονισμού που σχετίζεται με το μόριο με τη μορφή φάσματος IR. Για να μάθετε περισσότερα σχετικά με την επιστήμη πίσω από τη φασματοσκοπία υπερύθρων, ανατρέξτε σε αυτό το άρθρο.
Σε ένα φάσμα υπερύθρων, ορισμένες «κορυφές» (ή μάλλον «κοιλάδες») αντιστοιχούν σε μια σημαντική συχνότητα συντονισμού ενός δεσμού που βρίσκεται στην ένωση σας.
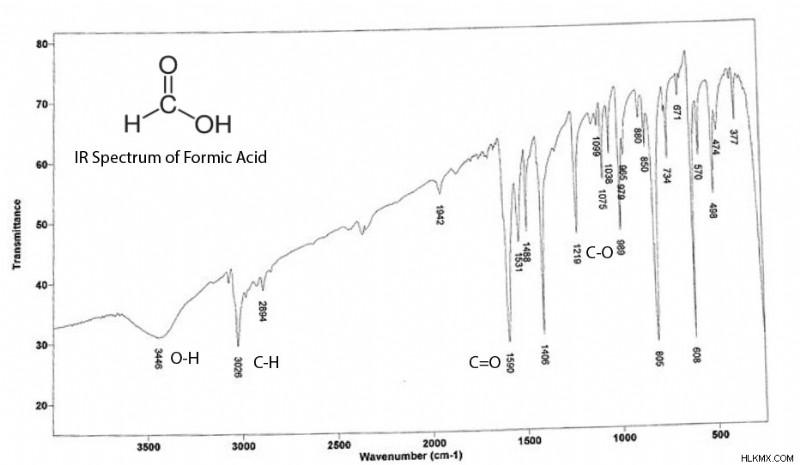
Ο άξονας x εμφανίζεται σε μονάδες αντίστροφων εκατοστών (cm), που ονομάζονται επίσης «κυματισμοί», που υποδηλώνει το αντίστροφο της συχνότητας συντονισμού. Γενικά, οι υψηλότεροι κυματοαριθμοί δείχνουν ισχυρότερο δεσμό. Για παράδειγμα, οι διπλοί δεσμοί άνθρακα-άνθρακα (~1680 cm) έχουν υψηλότερους κυματοαριθμούς από τους αρωματικούς δεσμούς άνθρακα-άνθρακα (~1500 cm) αλλά χαμηλότερους από τους τριπλούς δεσμούς άνθρακα-άνθρακα (~2200 cm).
Είναι σημαντικό ότι ο ίδιος δεσμός μπορεί να έχει διαφορετικούς κυματοαριθμούς ανάλογα με τη χημεία της γύρω περιοχής στο μόριο. Μια ομάδα καρβονυλίου σε ένα αμίδιο (~1690 cm) έχει συνήθως διαφορετικό συντονισμό από ένα καρβονύλιο σε ένα καρβοξυλικό οξύ (~1750 cm). Η σύζευξη μπορεί επίσης να επηρεάσει τους κυματικούς αριθμούς, ειδικά στα καρβονύλια.
Ο άξονας y δείχνει την ένταση της κορυφής, η οποία τείνει να αυξάνεται με δεσμούς με ισχυρότερες διπολικές ροπές. Για παράδειγμα, οι ομάδες καρβονυλίου τείνουν να έχουν πολύ υψηλότερη ένταση από τους μη πολικούς διπλούς δεσμούς άνθρακα-άνθρακα.
Ευτυχώς, οι συχνότητες συντονισμού υπερύθρων για τους περισσότερους δεσμούς μπορούν να βρεθούν σε πίνακα σε πολλά σχολικά βιβλία και διαδικτυακούς πόρους. Μια ολοκληρωμένη λίστα με τους κοινούς κυματικούς αριθμούς ομολόγων μπορείτε να βρείτε εδώ.
Φασματική Ανάλυση II:Φασματοσκοπία NMR
Τέλος, μόλις γνωρίσουμε τις πιο σημαντικές λειτουργικές ομάδες, μπορούμε να χρησιμοποιήσουμε τη φασματική ανάλυση NMR για να κατανοήσουμε καλύτερα τον υδρογονανθρακικό σκελετό του μορίου μας. Όταν ένα άτομο έχει πυρηνικό σπιν, εκφράζει μια μαγνητική διπολική ροπή. Αυτή η διπολική ροπή κατά συνέπεια περιλαμβάνει κάποια ενεργειακή αλλαγή από τη θεμελιώδη κατάσταση του ατόμου την οποία το NMR μετρά ως συχνότητα. Ωστόσο, αυτό ισχύει μόνο για άτομα με πυρηνικό σπιν, όπως το υδρογόνο-1 (Η) και ο άνθρακας-13 (C). Εάν θέλετε να μάθετε περισσότερα σχετικά με τη φυσική της φασματοσκοπίας NMR, ρίξτε μια ματιά σε αυτό το άρθρο.
Στην H NMR, την πιο κοινή μέθοδο, χημικά διαφορετικά υδρογόνα εκπέμπουν μετρήσιμα διαφορετικές συχνότητες. Η φασματοσκοπία NMR ποσοτικοποιεί αυτές τις συχνότητες σε ppm, με υψηλότερες τιμές που υποδεικνύουν ισχυρότερες διπολικές ροπές. Είναι σημαντικό ότι τα μαγνητικά πεδία των άλλων ατόμων κοντά σε ένα υδρογόνο μετατοπίζουν το πυρηνικό σπιν του, ανάλογα με την κατανομή των ηλεκτρονίων στο μόριο. Γενικά, τα περισσότερα υδρογόνα φτωχά σε ηλεκτρόνια ή «αποθωρακισμένα» έχουν υψηλότερα ppm από τα πλούσια σε ηλεκτρόνια ή τα «θωρακισμένα» υδρογόνα. Το φασματογράφημα NMR αντανακλά αυτή τη «χημική μετατόπιση» χημικά μοναδικών υδρογόνων. Μια ολοκληρωμένη λίστα με κοινές χημικές μετατοπίσεις NMR μπορείτε να βρείτε εδώ.
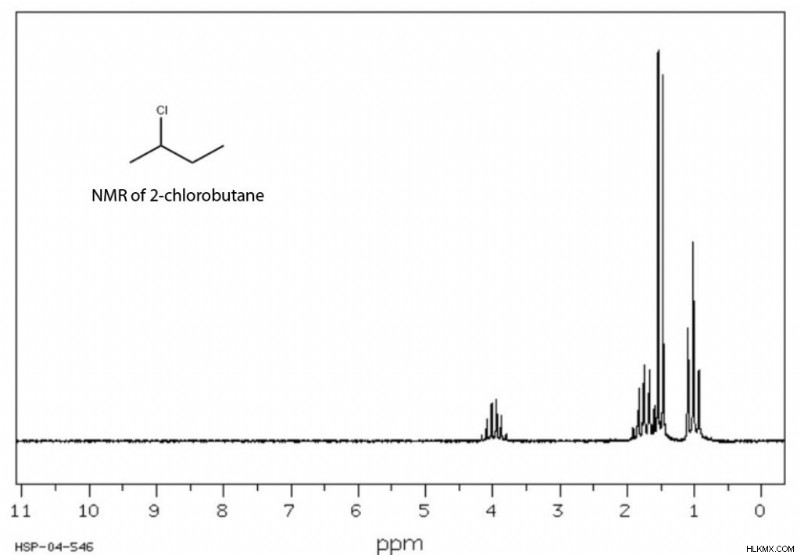
Μπορεί να παρατηρήσετε ότι οι κορυφές στο NMR συχνά ομαδοποιούνται σε δύο, τρία, τέσσερα και ούτω καθεξής. Αυτό προέρχεται από το φαινόμενο «διάσπασης» των γειτονικών υδρογόνων, το οποίο ακολουθεί τον κανόνα «n + 1». μια ομάδα τεσσάρων κορυφών δείχνει ότι υπάρχουν τρία υδρογόνα σε γειτονικά άτομα, τρεις κορυφές υποδεικνύουν δύο κοντινά υδρογόνα, και ούτω καθεξής.
Τέλος, μπορείτε να ενσωματώσετε ομάδες κορυφών. Η σχετική περιοχή κάτω από μια ομάδα κορυφών δείχνει τον αριθμό των υδρογόνων σε αυτή τη συχνότητα. Συγκεκριμένα, οι κορυφές που αντιπροσωπεύουν τρία υδρογόνα έχουν τριπλάσιο εμβαδόν από εκείνες που αντιπροσωπεύουν ένα υδρογόνο, το μισό εμβαδόν από αυτές που αντιπροσωπεύουν έξι υδρογόνα κ.ο.κ.
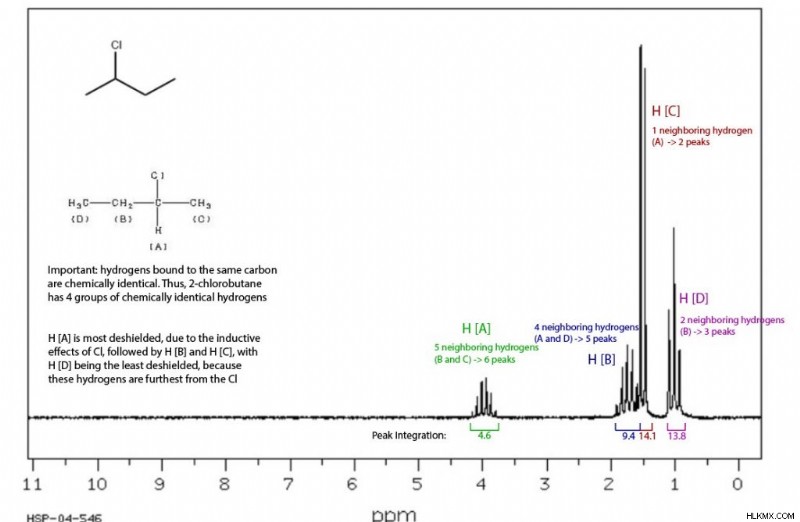
Με όλες αυτές τις περιπλοκές, το NMR είναι ένα ισχυρό αναλυτικό εργαλείο, όπως θα δούμε στην επόμενη ενότητα.
Πλήρης φασματική ανάλυση:ένα παράδειγμα
Για να κατανοήσουμε πλήρως τον τρόπο με τον οποίο κάθε μία από αυτές τις μεθόδους συμπληρώνει η μία την άλλη, ας ρίξουμε μια ματιά σε ένα παράδειγμα. Λάβετε υπόψη:οι καθηγητές συνήθως χρησιμοποιούν προβλήματα όπως αυτό στις εξετάσεις οργανικής χημείας στο κολέγιο!
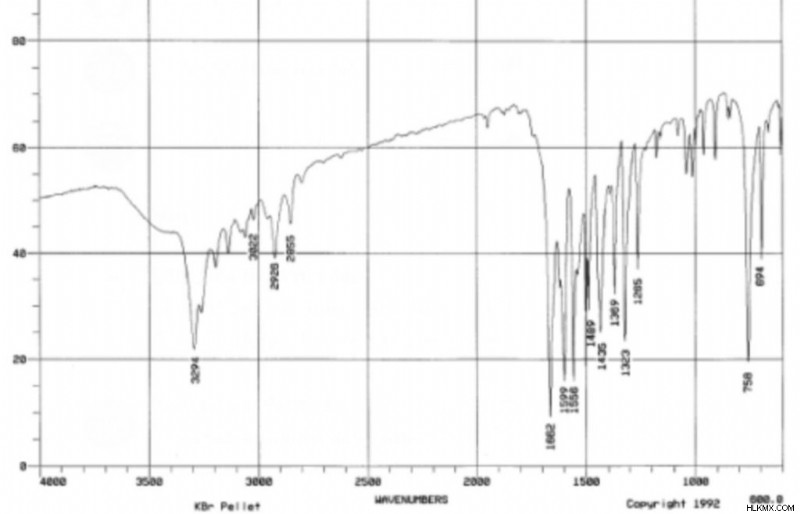
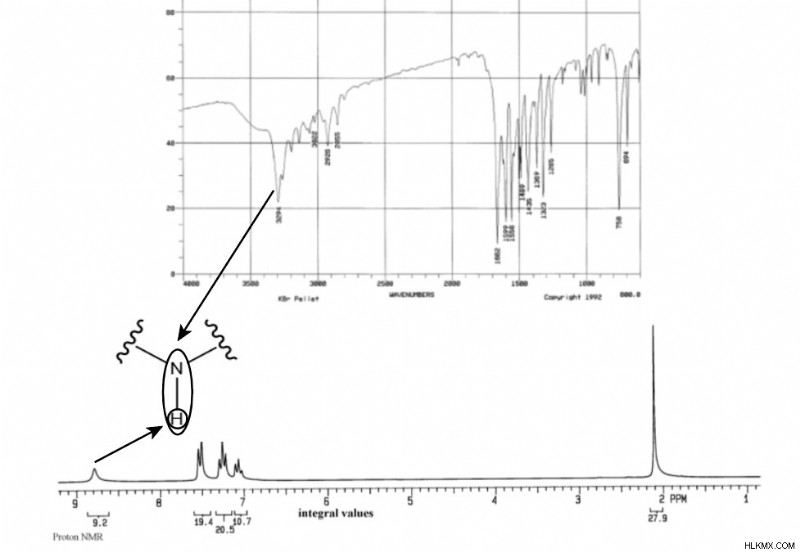
Ας υποθέσουμε ότι έχετε μια άγνωστη ένωση που παρήχθη αυθόρμητα στο εργαστήριο μια μέρα. Εκτελείτε μια προδιαγραφή μάζας στο δείγμα και έχει τον ακόλουθο τύπο:C8 H9 ΕΠΙ. Στη συνέχεια, εκτελείτε φασματοσκοπίες IR και NMR στο δείγμα και παράγονται τα ακόλουθα φάσματα:
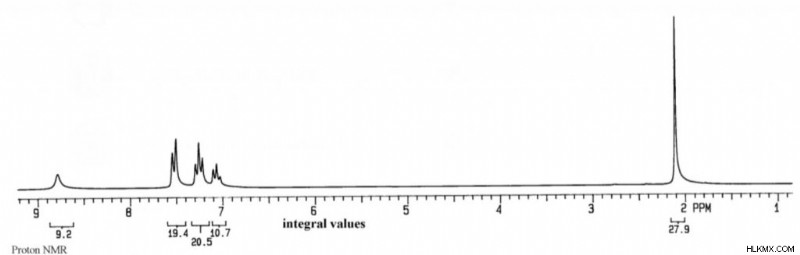
Ανάλυση ακορεστότητας
Για να καταλάβουμε πρώτα το άγνωστό μας, πρέπει να υπολογίσουμε τους βαθμούς ακορέστου του. Με τον τύπο, βρίσκουμε ότι ο άγνωστος έχει 5 βαθμούς ακόρεστου.
DoU =(2(C) + 2 – (H + X – N))/2 =(2(8) + 2 – (8 – 1))/2 =5
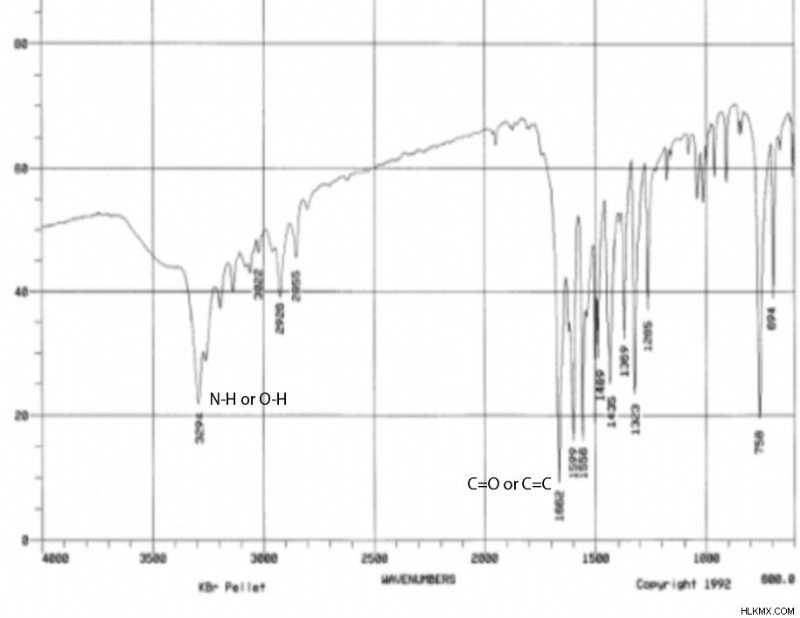
Φασματική Ανάλυση IR
Δεύτερον, μπορούμε να παρατηρήσουμε ότι οι συχνότητες IR στα 3296cm και 1662cm έχουν πιθανώς τη μεγαλύτερη σημασία. Οι άλλες κορυφές IR πιθανότατα αντιστοιχούν σε δεσμούς C-H και C-C που δεν μας λένε πολλές χρήσιμες πληροφορίες. Εξετάζοντας έναν πίνακα συχνοτήτων IR, η κορυφή στα 3296 cm θα μπορούσε να αντιστοιχεί σε έναν δεσμό N-H ή έναν δεσμό O-H. Η κορυφή στα 1662 cm θα μπορούσε να υποδεικνύει έναν δεσμό C=O ή C=C. Καθένας από αυτούς τους δεσμούς είναι δυνατός με βάση τον τύπο μας.
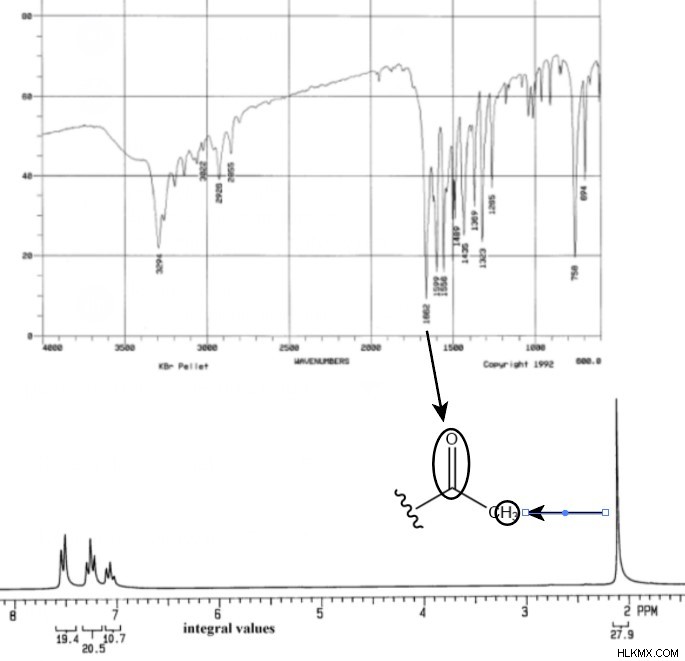
Φασματική Ανάλυση NMR
Τρίτον, η κορυφή NMR στις 2,1 ppm φαίνεται σημαντική. Δεδομένης της τιμής ολοκλήρωσής της 27,9 και της μικρότερης τιμής στο διάγραμμα 9,2, αυτή η κορυφή πρέπει να αντιστοιχεί σε τρία υδρογόνα. Αν αναφερθούμε σε έναν πίνακα συχνοτήτων NMR, βλέπουμε ότι 2,1 ppm τείνει να αντιστοιχεί σε ομάδες μεθυλίου που γειτνιάζουν με ένα καρβονύλιο. Αυτό είναι λογικό αφού προηγουμένως σημειώσαμε ότι το C=O ήταν δυνατό. Επίσης, αυτό θα σήμαινε ότι δεν υπάρχουν γειτονικά υδρογόνα για να χωρίσουν τα μεθυλ υδρογόνα. Αντίστοιχα, η κορυφή στις 2,1 σελ./λεπτό δεν έχει καθόλου διαχωρισμό.
Σύνθετη αναγνώριση
Με την επιβεβαίωση του καρβονυλίου, μπορούμε να αποκλείσουμε το O-H ως την κορυφή των 3296 cm, αφού μόνο ένα οξυγόνο υπάρχει στη δομή. Έτσι, κάπου πρέπει να έχουμε ένα Ν-Η. Επιπλέον, το καρβονύλιο αντιπροσωπεύει 1 από τις 5 μονάδες ακόρεστου με 4 να απομένουν. Αυτό πιθανότατα σημαίνει ότι πρέπει να προσθέσουμε μια ομάδα φαινυλίου κάπου για να απορροφήσει τις υπόλοιπες από αυτές τις μονάδες ακόρεστου.
Επιστρέφοντας στο NMR, μπορούμε να δούμε μια ομάδα τριών διαιρεμένων κορυφών μεταξύ 7,0 και 7,5. Η ολοκλήρωση (19.4, 20.5, 10.7) δείχνει ότι αυτή η ομάδα αντιστοιχεί σε πέντε συνολικά υδρογόνα. Λαμβάνοντας υπόψη τη διαίρεση, βλέπουμε δύο υδρογόνα με έναν γείτονα, δύο υδρογόνα με δύο γείτονες και ένα υδρογόνο με δύο γείτονες. Όλα αυτά τα σημεία δεδομένων υποδεικνύουν μια μονουποκατεστημένη ομάδα φαινυλίου.
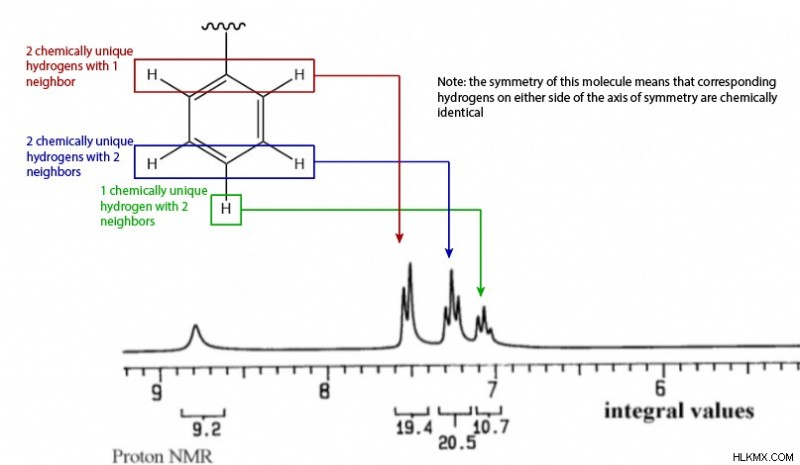
Αυτό το φαινύλιο παρέχει τρεις δεσμούς pi και έναν δακτύλιο, που αντιπροσωπεύουν τις υπόλοιπες μονάδες ακόρεστου.
Η τελική κορυφή στα 9,2 ppm πρέπει στη συνέχεια να αντιστοιχεί στο υδρογόνο στον δεσμό Ν-Η. Αυτή η κορυφή δεν έχει διασπάσεις, υποδεικνύοντας ότι δεν υπάρχουν γειτονικά υδρογόνα.
Για να υπάρχει αυτό στη δομή μας, πρέπει να τοποθετήσουμε το άζωτο μεταξύ του φαινυλίου και του καρβονυλίου, αποδίδοντας την τελική μας δομή.
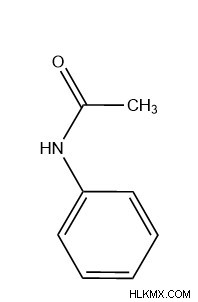
Αυτή η τελική δομή έχει έτσι ένα δευτεροταγές αμίδιο. Για έναν τελικό έλεγχο, μπορούμε να παρατηρήσουμε ότι ο δεσμός C=O σε ένα δευτερεύον αμίδιο έχει τυπικά συχνότητα 1680 cm. Μπορούμε να δούμε ότι αυτό είναι αξιοσημείωτα κοντά στους κυματοαριθμούς των 1669 cm στο φάσμα υπερύθρων μας.




