Ηλεκτρόφιλη Αρωματική Υποκατάσταση
Βασικές έννοιες
Σε αυτό το άρθρο, θα μάθετε για τα βασικά της ηλεκτρόφιλης αρωματικής υποκατάστασης, τους σημαντικούς μηχανισμούς και την τοποεπιλεκτικότητα.
Τι είναι η Ηλεκτρόφιλη Αρωματική Υποκατάσταση;
Παρά την αξιοσημείωτη σταθερότητα των αρωματικών ενώσεων, όπως το βενζόλιο, οι οργανικοί χημικοί έχουν βρει τρόπους χημικής αλλαγής της δομής τους. Στη σύνθεση, αυτές οι αλλαγές τυπικά συμβαίνουν μέσω αντιδράσεων υποκατάστασης, όπου μια νέα χημική ομάδα αντικαθιστά ένα υδρογόνο στον αρωματικό δακτύλιο. Είναι σημαντικό ότι αυτές οι αντιδράσεις διατηρούν την κυκλική κίνηση των ηλεκτρονίων σε αρωματικές ενώσεις, διατηρώντας τη χημική τους σταθερότητα.
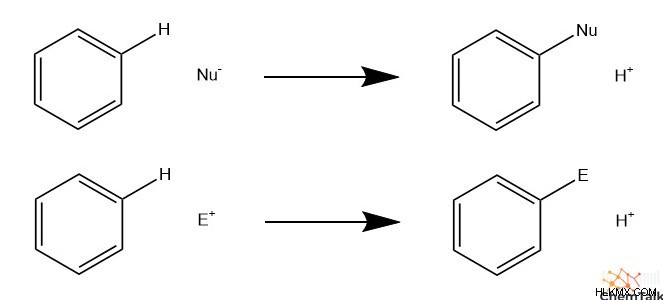
Στην ηλεκτρόφιλη αρωματική υποκατάσταση (EAS), μια ηλεκτρόφιλη ομάδα προστίθεται στον αρωματικό δακτύλιο, όπως υδρογονάνθρακας, νιτρικό ή θειικό άλας. Το EAS έχει ένα αντίστοιχο που περιλαμβάνει πυρηνόφιλα, που ονομάζεται κατάλληλα πυρηνόφιλη αρωματική υποκατάσταση (NAS). Το EAS και το NAS ακολουθούν παρόμοιους μηχανισμούς, αλλά υπάρχουν μοναδικές ιδιορρυθμίες στην αντίδραση EAS που δεν κοινοποιούνται στο NAS.
Μηχανισμός Ηλεκτρόφιλης Αρωματικής Υποκατάστασης
Το πρώτο βήμα στις αντιδράσεις ηλεκτρόφιλης υποκατάστασης περιλαμβάνει ένα ζεύγος ηλεκτρονίων pi από τον αρωματικό δακτύλιο που επιτίθεται σε ένα ηλεκτρόφιλο. Αυτό σπάει προσωρινά την αρωματικότητα του δακτυλίου και τοποθετεί ένα θετικό φορτίο στον άνθρακα που συνδέεται με το ηλεκτρόφιλο. Στη συνέχεια, μια γενική βάση αποπρωτονιώνει τον θετικό άνθρακα, ο οποίος ελευθερώνει ένα ζεύγος ηλεκτρονίων. Τέλος, αυτό το ζεύγος ηλεκτρονίων σχηματίζει έναν δεσμό pi εντός της κυκλικής δομής του άνθρακα, ο οποίος γίνεται ξανά αρωματικός.
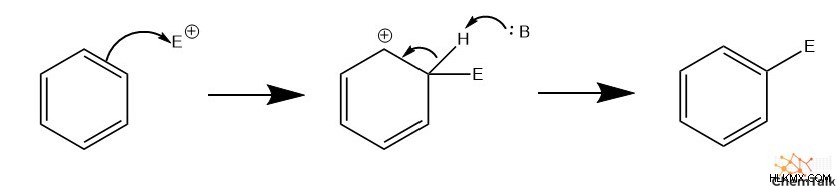
Είναι σημαντικό ότι η αρωματικότητα της ένωσης πρέπει να σταματήσει προσωρινά κατά τη διάρκεια του EAS, αλλά να επιστρέψει για να σχηματίσει το τελικό προϊόν. Οποιαδήποτε χημική αλλαγή σε μια αρωματική δομή πρέπει συχνά να περιλαμβάνει την επιστροφή της αρωματικότητας όταν ολοκληρωθεί η αντίδραση. Αυτό οφείλεται στην αξιοσημείωτη σταθερότητα των αρωματικών ενώσεων. Προκειμένου μια αντίδραση να μετατρέψει πλήρως μια αρωματική δομή σε μια μη αρωματική, μια τέτοια αντίδραση θα ήταν πιθανώς θερμοδυναμικά δυσμενής χωρίς δραστικές περιβαλλοντικές συνθήκες ή εξαιρετικά αποτελεσματικούς καταλύτες.
Παραδείγματα Ηλεκτρόφιλης Αρωματικής Υποκατάστασης
Αλκυλίωση Friedel-Crafts
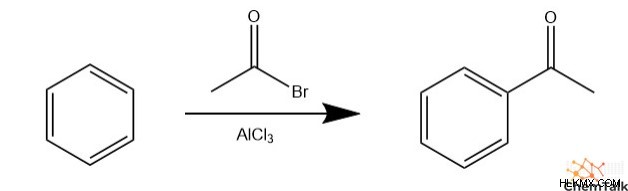
Για να τοποθετηθεί ένας υδρογονάνθρακας σε έναν αρωματικό δακτύλιο, πρέπει να λάβει χώρα μια συγκεκριμένη αντίδραση EAS που ονομάζεται αλκυλίωση Friedel-Crafts. Αυτή η αντίδραση περιλαμβάνει δύο σημαντικά αντιδρώντα, ένα αλκυλαλογονίδιο και ένα οξύ Lewis, συνήθως AlCl3 . Το οξύ Lewis αφαιρεί πρώτα το αλογόνο, αφήνοντας ένα καρβοκατιόν. Το καρβοκατιόν χρησιμεύει στη συνέχεια ως ηλεκτρόφιλο στο EAS.

Οι χημικοί χρησιμοποιούν τον όρο "Friedel-Crafts Acylation" για να περιγράψουν μια παρόμοια αντίδραση που περιλαμβάνει ένα αλογονίδιο οξέος αντί για ένα αλκυλαλογονίδιο.
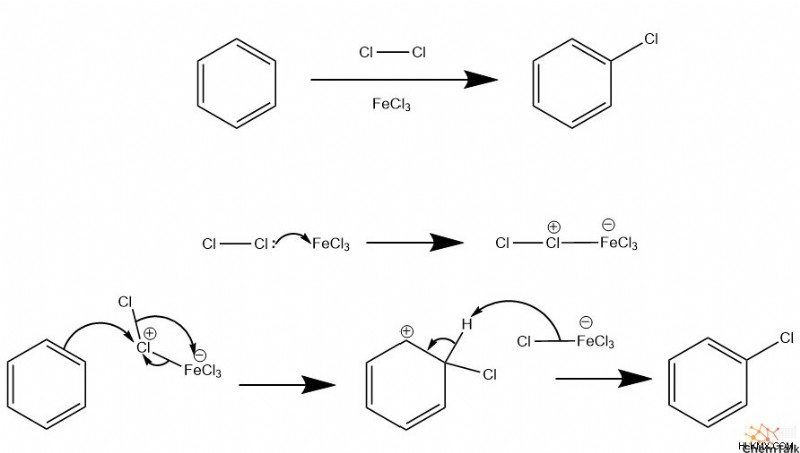
Αλογόνωση
Για να αλογονώσετε έναν αρωματικό δακτύλιο, χρειάζεστε επίσης ένα οξύ Lewis, συνήθως FeCl3 ή FeBr3 , καθώς και ένα διατομικό αλογόνο. Το οξύ Lewis συνδέεται με το αλογόνο, γεγονός που το καθιστά πιο ηλεκτροφιλικό. Στη συνέχεια, το ηλεκτρόφιλο αλογόνο μπορεί να εκτελεί EAS με μια αρωματική ουσία. Λόγω της πολυπλοκότητας του ενδιάμεσου οξέος αλογόνου-Lewis, πρέπει να συμβεί μια περίπλοκη σειρά αναδιατάξεων κατά τη διάρκεια του EAS.
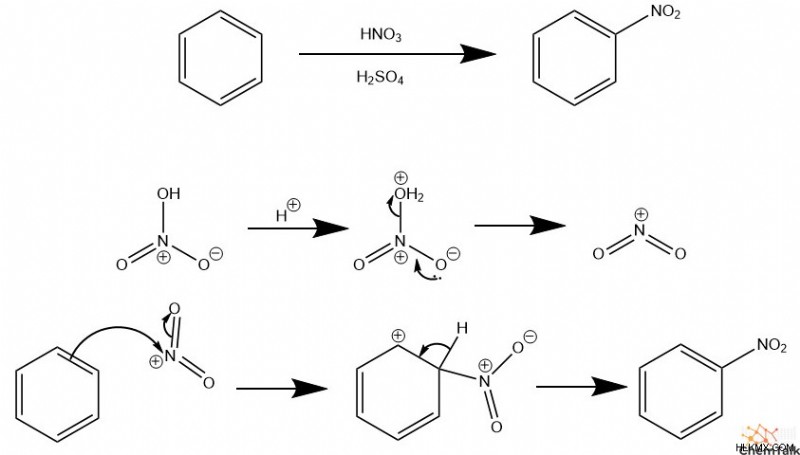
Νίτρωση
Για να τοποθετήσετε μια νίτρο ομάδα σε έναν αρωματικό δακτύλιο, μια ειδική ένωση που ονομάζεται ιόν νιτρονίου, η οποία δρα ως ηλεκτρόφιλο σε ηλεκτροφιλική αρωματική υποκατάσταση. Για να δημιουργηθεί ένα ιόν νιτρονίου, το νιτρικό οξύ πρέπει να πρωτονιωθεί από κάποιο άλλο οξύ, το οποίο αποσταθεροποιεί τη δομή του, με αποτέλεσμα την απελευθέρωση μιας υδροξυομάδας. Τυπικά, το θειικό οξύ χρησιμεύει ως δευτερογενές οξύ επειδή η συζευγμένη βάση του, το διόξινο θειικό, δεν είναι πολύ πυρηνόφιλο και επομένως δεν θα ανταγωνιζόταν το νιτρόνιο για να αντιδράσει με τον αρωματικό δακτύλιο.
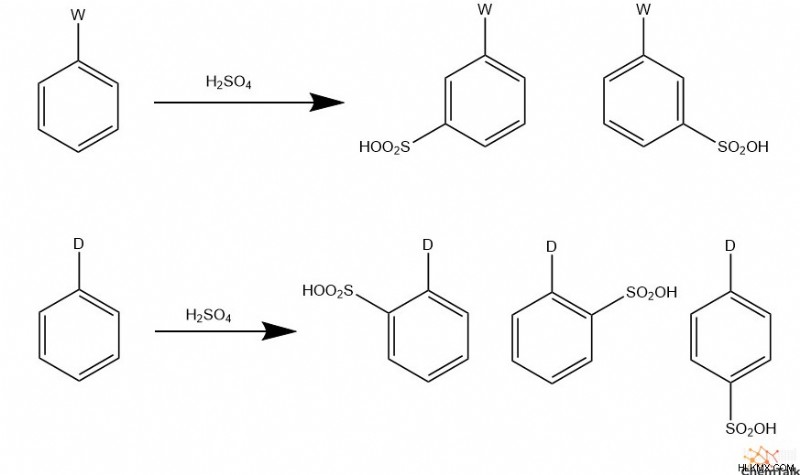
Σουλφόνωση
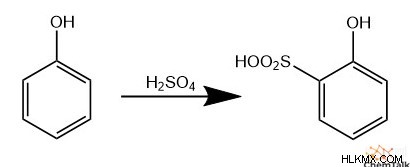
Μετά από μια παρόμοια αντίδραση, η σουλφόνωση περιλαμβάνει την αντίδραση του θειικού οξέος με τον εαυτό του για τη δημιουργία ηλεκτροφιλικού τριοξειδίου του υδρογόνου. Αυτό το ηλεκτρόφιλο είδος μπορεί στη συνέχεια να εκτελέσει EAS, το οποίο έχει ως αποτέλεσμα ένα αρνητικά φορτισμένο οξυγόνο μετά την αποπρωτονίωση του αρωματικού δακτυλίου. Εφόσον υπάρχει θειικό οξύ που δεν αντέδρασε στο μείγμα της αντίδρασης, αυτό το οξυγόνο πρωτονιώνεται.
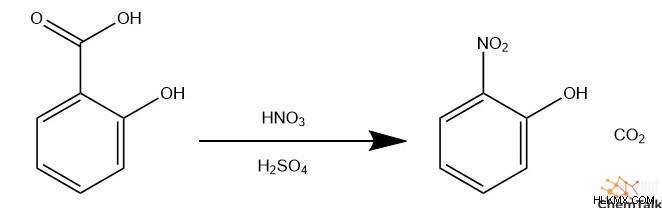
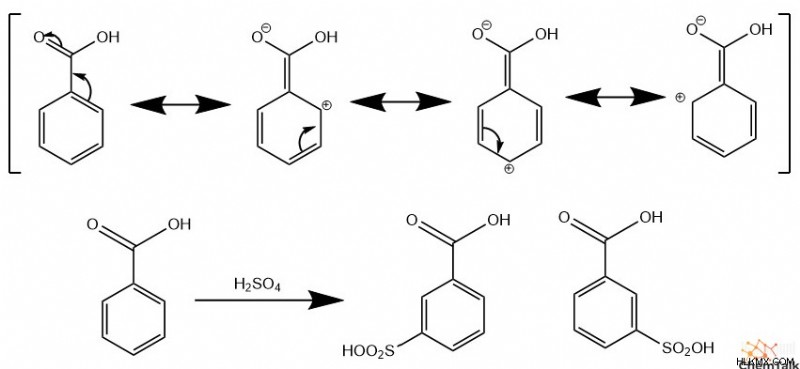
Ipso Αντικατάσταση
Μερικές φορές, αντί να αντικαταστήσει ένα υδρογόνο στον αρωματικό δακτύλιο, ένα επιτιθέμενο ηλεκτρόφιλο αντικαθιστά έναν άλλο υποκαταστάτη. Οι χημικοί το αποκαλούν "ipso- αντικατάσταση» ή «ipso -επίθεση". Για παράδειγμα, όταν εκτελείται νίτρωση σε σαλικυλικό οξύ, το εισερχόμενο ιόν νιτρονίου αντιδρά με τον άνθρακα που περιέχει το καρβοξυλικό οξύ. Αυτό απελευθερώνει την καρβοξυλική ομάδα από τον δακτύλιο ως διοξείδιο του άνθρακα.
Τοποεκλεκτικότητα Ηλεκτρόφιλης Αρωματικής Υποκατάστασης
Είναι ενδιαφέρον ότι εάν μια αρωματική ένωση έχει ήδη υποκαταστάτες και στη συνέχεια εκτελεί EAS, το ηλεκτρόφιλο μπορεί να είναι πιο πιθανό να αντιδράσει με ορισμένες θέσεις στον δακτύλιο από άλλες. Αυτή η τάση ορισμένων περιοχών ενός μορίου να είναι πιο πιθανό να αντιδράσουν από άλλες ονομάζεται τοποεπιλεκτικότητα.
Η συγγένεια ηλεκτρονίων των υποκαταστατών έχει τη μεγαλύτερη επιρροή στην τοποεκλεκτικότητα στην αρωματική ηλεκτροφιλική υποκατάσταση. Συγκεκριμένα, στο μονουποκατεστημένο βενζόλιο, οι ομάδες που αποσύρουν ηλεκτρόνια ονομάζονται μετα διευθυντές. Αυτό σημαίνει ότι τα ηλεκτρόφιλα έχουν υψηλότερη αντιδραστικότητα με άνθρακες δύο σημεία μακριά από τον υποκαταστάτη. Αντίθετα, οι ομάδες που δότες ηλεκτρονίων ονομάζονται para/ortho διευθυντές. Αυτό σημαίνει ότι τα ηλεκτρόφιλα έχουν υψηλότερη αντιδραστικότητα με άνθρακες παρακείμενους (ortho ) ή απέναντι (παρά ) ο υποκαταστάτης. Αυτές οι σχέσεις μεταξύ των υποκαταστατών και της τοποεπιλεκτικότητας πληροφορούν τις οδούς αντίδρασης σύνθεσης που περιλαμβάνουν αρωματικές ουσίες.

Ο λόγος για τον οποίο ορισμένες ομάδες κάνουν ορισμένους άνθρακες πιο αντιδραστικούς στα ηλεκτρόφιλα προέρχεται από τον συντονισμό. Ας ρίξουμε μια πιο προσεκτική ματιά.
Meta Διευθυντές
Όπως αναφέρθηκε προηγουμένως, οι ομάδες που αποσύρουν ηλεκτρόνια, όπως τα καρβονύλια, τα αλογονίδια και οι νίτρο ομάδες, κατευθύνουν τα ηλεκτρόφιλα σε δεσμούς με μετα άνθρακες. Αυτό προέρχεται από μερικά θετικά φορτία που τοποθετούνται στους άνθρακες ortho και παρά στην ομάδα απόσυρσης, που προέρχεται από τις μορφές συντονισμού του μορίου. Ως αποτέλεσμα, το μημετα Οι άνθρακες απωθούν ηλεκτροστατικά τα ηλεκτρόφιλα, δημιουργώντας μετα άνθρακες σχετικά πιο αντιδραστικοί στα EAS. Ωστόσο, οι χημικοί χρησιμοποιούν τον όρο «απενεργοποιητική ομάδα» για να περιγράψουν αυτά τα μετα διευθυντές, επειδή το βενζόλιο με μια ομάδα που αποσύρει ηλεκτρόνια έχει σημαντικά μικρότερη συνολική αντιδραστικότητα από το μη υποκατεστημένο βενζόλιο, λόγω της μειωμένης πυκνότητας ηλεκτρονίων στη δομή του δακτυλίου.
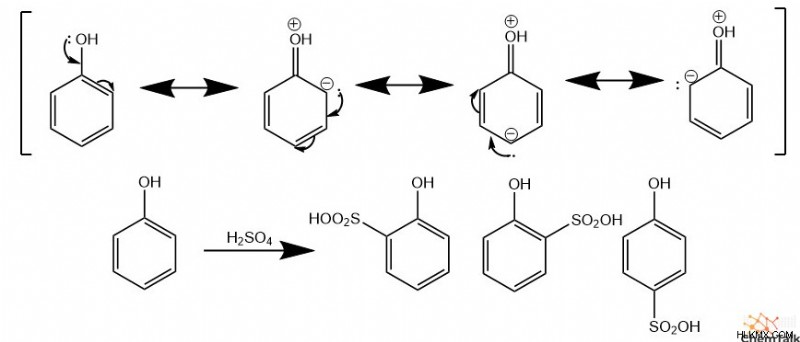
Para/Ortho Διευθυντές
Ομάδες δωρητών ηλεκτρονίων, όπως υδρογονάνθρακες, αλκοόλες, οξικά και αμινοξέα, κατευθύνουν τα ηλεκτρόφιλα να συνδεθούν με το ortho και παρά άνθρακες. Αυτό προέρχεται από μερικά αρνητικά φορτία που τοποθετούνται στους άνθρακες όρθο και παρά στην ομάδα δωρητών, που προέρχονται από τις μορφές συντονισμού του μορίου. Ως αποτέλεσμα, ortho και παρά ομάδες έλκουν ηλεκτροστατικά τα ηλεκτρόφιλα. Επιπλέον, οι χημικοί αποκαλούν τις ομάδες δωρεάς «ομάδες ενεργοποίησης» επειδή προσθέτουν πυκνότητα ηλεκτρονίων στον αρωματικό δακτύλιο, καθιστώντας τον πιο αντιδραστικό από το μη υποκατεστημένο βενζόλιο έναντι των ηλεκτρόφιλων.
Δεδομένης μιας ομάδας δωρητών ηλεκτρονίων, ένα ηλεκτρόφιλο μπορεί κατά προτίμηση να αντιδράσει με την παρά άνθρακα πάνω από τον όρθο άνθρακες ή το αντίστροφο. Αυτό το επίπεδο τοποεπιλεκτικότητας εξαρτάται από τα στερικά της ομάδας δωρητών. Εάν η ομάδα είναι μεγάλη και ογκώδης, τα ηλεκτρόφιλα αντιδρούν κατά προτίμηση με την παρά άνθρακα επειδή ο κύριος όγκος της ομάδας δωρητών στερικά εμποδίζει ένα εισερχόμενο μόριο να αλληλεπιδράσει με το παρακείμενο ortho άνθρακες.
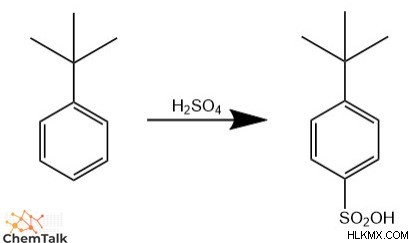
Αντίθετα, εάν η ομάδα είναι μικρή με μικρό στερικό αποτέλεσμα, τα ηλεκτροφιλικά είναι πιο πιθανό να πραγματοποιήσουν υποκατάσταση στον όρθο άνθρακες επειδή τα βενζόλια έχουν δύο όρθο άνθρακες και μόνο μία παρά άνθρακας. Συγκεκριμένα, το ηλεκτρόφιλο θα είχε ίση πιθανότητα να αντιδράσει με τα δύο όρθο άνθρακες και ένα παρά άνθρακα, επομένως το μείγμα προϊόντων θα περιλαμβάνει 67% ortho προϊόν και 33% παρά προϊόν.