Εξηγούνται οι βαθμοί ακορεστότητας
Βασικές έννοιες
Σε αυτό το άρθρο, εξετάζουμε προσεκτικά τους "Βαθμούς ακορεστότητας", συμπεριλαμβανομένου του τι είναι, του τρόπου υπολογισμού τους και ορισμένων σημαντικών προειδοποιήσεων σχετικά με την έννοια.
Τι είναι οι Βαθμοί Ακορεσμού;
Ο "Βαθμός Ακορεσμού", γνωστός και ως "Δείκτης Ανεπάρκειας Υδρογόνου", είναι ένα σημαντικό εργαλείο που χρησιμοποιούν οι χημικοί όταν προσπαθούν να αναγνωρίσουν μια άγνωστη ένωση. Στην οργανική χημεία, ο ακατέργαστος μοριακός τύπος δεν δίνει τόσες πολλές πληροφορίες σχετικά με τη δομή μιας ένωσης. Για παράδειγμα, μπορούμε να φανταστούμε ένα πλήθος δομών που ταιριάζουν με τον τύπο C7 H9 O3 Ν.
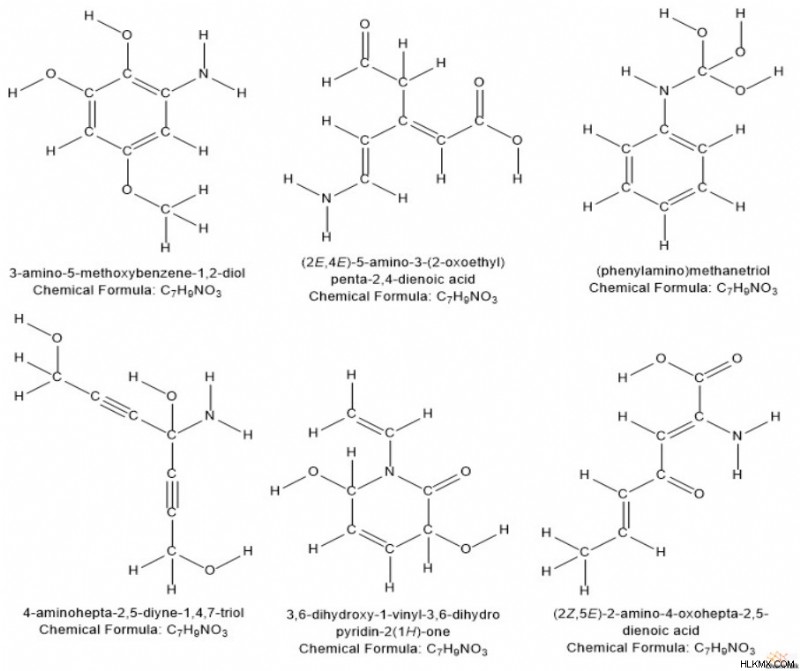
Ωστόσο, κοιτάζοντας μόνο τον τύπο, οι χημικοί μπορούν να υπολογίσουν τους «βαθμούς ακόρεστου» της ένωσης, κάτι που παρέχει λίγη περισσότερη εικόνα. Με απλά λόγια, οι βαθμοί ακόρεστου μιας δομής είναι το συνολικό άθροισμα των δεσμών pi και των δομών δακτυλίου της.
Είναι σημαντικό ότι ο «ακόρεστος» δεν αναφέρεται στον κορεσμό με την έννοια του διαλύτη-διαλυμένης ουσίας, αλλά μάλλον στον βαθμό στον οποίο ο άνθρακας είναι «κορεσμένος» με υδρογόνα. Μπορεί να θυμάστε από τη βιοχημεία ότι τα κορεσμένα λιπαρά οξέα έχουν περισσότερα υδρογόνα από τα ακόρεστα λιπαρά οξέα.
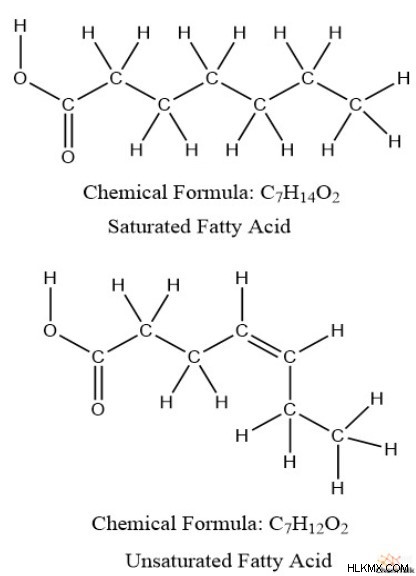
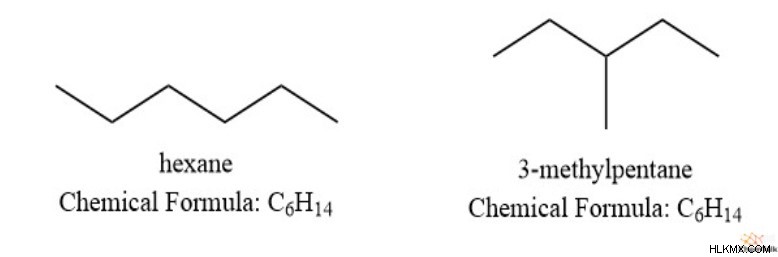
Επιπλέον, τα ακόρεστα λιπαρά οξέα έχουν περισσότερους δεσμούς pi, με τη μορφή διπλών δεσμών, από τα κορεσμένα λιπαρά οξέα. Από αυτό, μπορούμε να παρατηρήσουμε ότι υπάρχει κάποια αντίστροφη σχέση μεταξύ των δεσμών pi και των υδρογόνων. Επίσης, οι δομές δακτυλίου τείνουν να έχουν λιγότερα υδρογόνα από τις μη κυκλικές δομές. για παράδειγμα, πάρτε εξάνιο (C6 H14 ) έναντι κυκλοεξανίου (C6 H12 ).
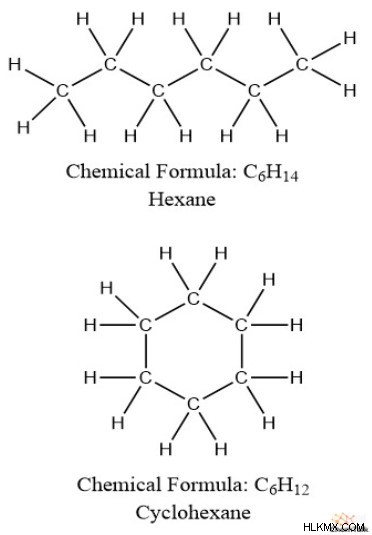
Αυτές οι σχέσεις μεταξύ υδρογόνων, δεσμών pi και δακτυλίων επηρεάζουν όλες τον τρόπο με τον οποίο υπολογίζουμε τους βαθμούς ακόρεστου.
Πώς να υπολογίσετε τους βαθμούς ακορεστότητας
Για έναν υδρογονάνθρακα χωρίς ετεροάτομα, μπορούμε να χρησιμοποιήσουμε τον ακόλουθο τύπο για να υπολογίσουμε τους βαθμούς ακορεστότητας:
DoU =(2C + 2 – H)/2
C =Αριθμός ανθράκων στον τύπο
H =Αριθμός υδρογόνων στον τύπο
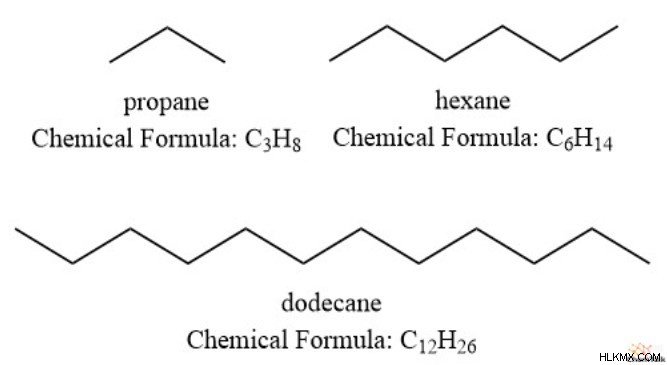
Όπως αναφέρθηκε προηγουμένως, οι συνολικοί βαθμοί ακορέστου υποδεικνύουν τους συνδυασμένους δεσμούς pi και δακτυλίους στη δομή. Αυτός ο τύπος προέρχεται από το γεγονός ότι ο μέγιστος αριθμός υδρογόνων σε έναν υδρογονάνθρακα είναι διπλάσιος από τον αριθμό των ανθράκων συν δύο. Μπορούμε να δούμε αυτό το φαινόμενο στις πλήρως κορεσμένες ενώσεις προπάνιο, εξάνιο και δωδεκάνιο.
Εάν ένας υδρογονάνθρακας έχει λιγότερα υδρογόνα, πρέπει έχουν δεσμούς pi ή δομές δακτυλίου. Αυτό γίνεται απίστευτα χρήσιμο, καθώς περιορίζει τις πιθανές δομές ενός τύπου σε λίγες μόνο εύλογες επιλογές.
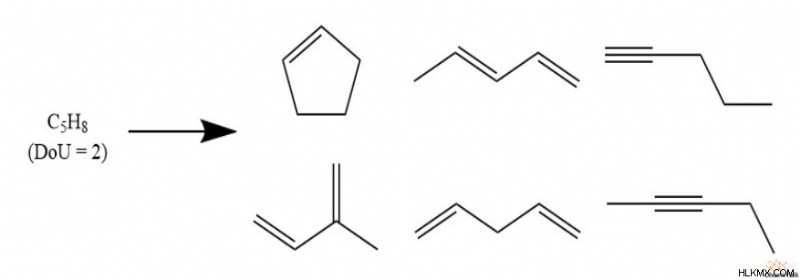
Ωστόσο, ακόμα κι αν μια ένωση έχει μηδενικούς βαθμούς ακορεστότητας και επομένως είναι πλήρως κορεσμένη, εξακολουθούν να υπάρχουν πολλές δομές που θα μπορούσε να υποδεικνύει ο τύπος. Για παράδειγμα, C6 H14 πιο συχνά υποδηλώνει εξάνιο, αλλά το 3-μεθυλπεντάνιο έχει τον ίδιο τύπο.
Επίσης, ως χρήσιμη συμβουλή, εάν μια σχετικά μικρή δομή (λιγότεροι από 10 άνθρακες) έχει αριθμό ακόρεστου 4 ή περισσότερο, οι πιθανότητες είναι μεγάλες να έχει μια ομάδα φαινυλίου. Αν και υπάρχουν εναλλακτικές δομές σε αυτές τις περιπτώσεις, πιθανότατα δεν έχουν την ίδια δομική σταθερότητα και απλότητα με ένα αρωματικό μόριο.
Οι βαθμοί ακορέστου φαίνονται χρήσιμοι για τους υδρογονάνθρακες, αλλά τι μας λέει όταν ο άγνωστος μας έχει οξυγόνο, άζωτο κ.λπ.;
Βαθμοί Ακορεσμού με Ετεροάτομα
Κατά την αξιολόγηση της επίδρασης ενός ετεροατόμου (χωρίς άνθρακα ή υδρογόνο) στον ακόρεστο, πρέπει να αναρωτηθούμε μια σημαντική ερώτηση:προσθέτει ή αφαιρεί πιθανές θέσεις για το υδρογόνο αυτό το άτομο;
Αλογόνα
Για να ξεκινήσουμε, ας δούμε τα αλογόνα. Προσέξτε, όταν το χλώριο ή το βρώμιο υπάρχει σε μια δομή, ουσιαστικά αντικαθιστά το υδρογόνο.
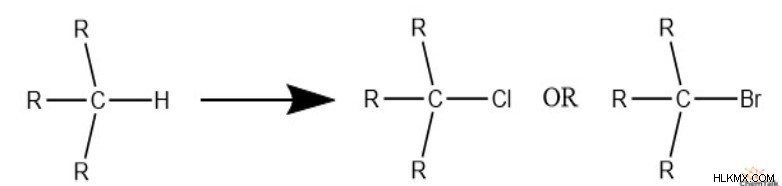
Για παράδειγμα, για μια δομή με δύο άνθρακες και ένα χλώριο, η δομή μπορεί να έχει μόνο έναν μέγιστο αριθμό πέντε υδρογόνων. Ωστόσο, δεδομένου ότι η δομή δεν έχει δεσμούς pi ή δακτυλίους, πρέπει να είναι ακόμα κορεσμένη και να έχει μηδενικές μονάδες ακόρεστου.
Έτσι, κατά τον υπολογισμό των βαθμών ακορεστότητας, πρέπει να προσθέσουμε τον αριθμό των αλογόνων στο σύνολο του υδρογόνου. Αυτό είναι λογικό αν σκεφτεί κανείς ότι κάθε αλογόνο σε μια ένωση υποδεικνύει μια θέση όπου θα μπορούσε να καταλάβει το υδρογόνο.
Άζωτο
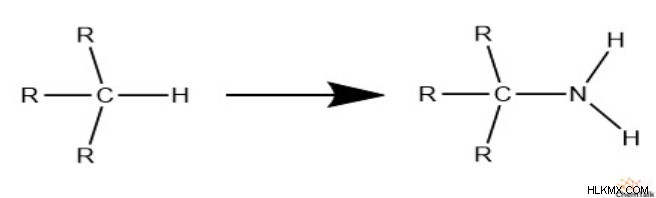
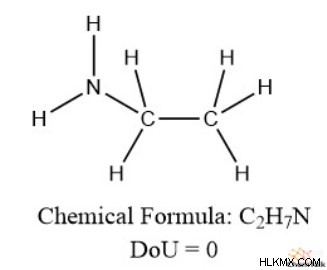
Στη συνέχεια, ας εξετάσουμε το άζωτο. Προσέξτε, όταν το άζωτο καταλαμβάνει έναν χώρο που θα μπορούσε να καταλάβει το υδρογόνο, παρέχει δύο επιπλέον χώρους για το υδρογόνο.

Αυτό είναι ένα καθαρό κέρδος μιας θέσης για τη σύνδεση του υδρογόνου. Έτσι, για να είναι μια δομή πλήρως κορεσμένη, πρέπει να έχει ένα επιπλέον υδρογόνο ανά άζωτο. Επομένως, πρέπει να αφαιρέσουμε τον αριθμό των αζώτων από τα υδρογόνα κατά τον υπολογισμό του ακορέστου.
Οξυγόνο και θείο
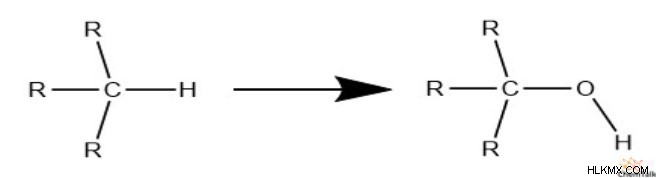
Τέλος, ας δούμε το οξυγόνο και το θείο. Σημειώστε ότι όταν οποιοδήποτε από τα δύο αντικαθιστά το υδρογόνο, παρέχει ένα χώρο για τη σύνδεση του υδρογόνου.
Αυτό σημαίνει ότι η παρουσία οξυγόνου και θείου έχει μηδενικό αντίκτυπο στον ακόρεστο. Μπορούμε να το δούμε αυτό στην αιθανόλη και την αιθανοθειόλη, που και οι δύο έχουν πλήρως κορεσμένες δομές.
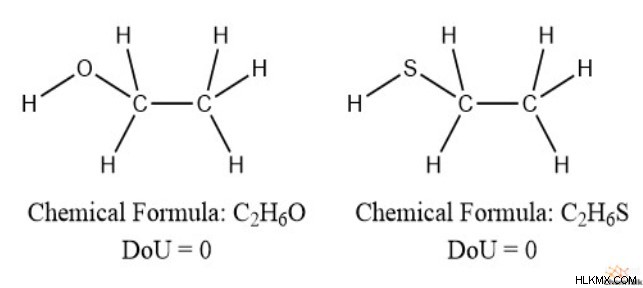
Έτσι, μπορούμε να αφήσουμε εντελώς έξω τα οξυγόνα και το θείο κατά τον υπολογισμό των βαθμών ακόρεστου.
Deluxe Degrees of Unsaturation Formula
Ενσωματώνοντας ό,τι γνωρίζουμε για τα ετεροάτομα, μπορούμε επομένως να χρησιμοποιήσουμε τον ακόλουθο τύπο για να υπολογίσουμε τον ακορεσμό για τις ετεροενώσεις:
Βαθμοί Ακορεσμού =(2C + 2 – (H + X – N))/2
C =Αριθμός ανθράκων στον τύπο
H =Αριθμός υδρογόνων στον τύπο
X =Αριθμός αλογόνων στον τύπο
N =Αριθμός αζώτων στον τύπο
Σημείωση:εάν η άγνωστη ένωση σας έχει ένα ετεροάτομο διαφορετικό από αυτά για τα οποία μιλήσαμε, όπως ένα μέταλλο μετάπτωσης, θα είχε απρόβλεπτη επίδραση στους βαθμούς ακόρεστου, επειδή πιθανότατα έχει μια σειρά από πιθανές καταστάσεις οξείδωσης. Ωστόσο, ο παραπάνω τύπος ισχύει για τη συντριπτική πλειοψηφία των ενώσεων που απαντώνται στα μαθήματα οργανικής χημείας.
Όπως αναφέρθηκε προηγουμένως, αν και ο υπολογισμός των βαθμών ακορεστότητας περιορίζει τις επιλογές σας, θα εξακολουθείτε να έχετε πολλές πιθανές ενώσεις για έναν δεδομένο τύπο. Έτσι, οι βαθμοί ακορεστότητας χρησιμοποιούνται καλύτερα σε συνδυασμό με τις τεχνικές Mass Spec, IR και NMR, οι οποίες παρέχουν τα δικά τους κομμάτια στο παζλ. Με κάθε τεχνική ανάλυσης, μπορείτε συχνά να εξαγάγετε την ακριβή δομή μιας οργανικής ένωσης. Για να το δείτε στην πράξη, ανατρέξτε σε αυτό το άρθρο για τη δομική ανάλυση.




