Δομή και σταθερότητα πρωτεΐνης
Βασικές έννοιες
Σε αυτό το σεμινάριο, θα μάθετε τι συνθέτει τη δομή της πρωτεΐνης και πώς παράγοντες, όπως η θερμοκρασία και το pH επηρεάζουν τη σταθερότητα μιας πρωτεΐνης. Θα μάθετε επίσης ότι η δομή και η σταθερότητα της πρωτεΐνης είναι σημαντικές για τη λειτουργία μιας πρωτεΐνης.
Θέματα που καλύπτονται σε άλλα άρθρα
- Διάγραμμα αμινοξέων
- Τι είναι η σηματοδότηση κυψέλης;
- GPCR – Υποδοχείς συζευγμένων με πρωτεΐνη G
- Ένζυμα – Λειτουργία και τύποι
- Γλυκόλυση:Ας το αναλύσουμε!
Τι είναι η δομή και η σταθερότητα της πρωτεΐνης;
Δομή πρωτεΐνης περιγράφει το συγκεκριμένο σχήμα που παίρνει μια πρωτεΐνη. Οι πρωτεΐνες μπορεί να είναι πολύ άκαμπτες στις δομές τους, πολύ χαλαρές ή κάπου ενδιάμεσα. Οι χημικές αλληλεπιδράσεις, όπως οι δεσμοί υδρογόνου, λειτουργούν σαν κόλλα για να συγκρατούν αυτές τις δομές μαζί. Η πρωταρχική αλληλουχία αμινοξέων μιας πρωτεΐνης είναι ένας μεγάλος παράγοντας για τον καθορισμό ποιες από αυτές τις χημικές αλληλεπιδράσεις μπορούν να σχηματιστούν και πού.
Οι πρωτεΐνες είναι δυναμικές. Πάντα κινούνται! Αυτό θα μπορούσε να σημαίνει μικρές κινήσεις, όπως ένα άτομο που δονείται, ή μεγαλύτερες κινήσεις, όπως μια πρωτεΐνη που αλλάζει το συνολικό της σχήμα. Σταθερότητα πρωτεΐνης είναι ένα μέτρο του πόσο καλά μια πρωτεΐνη «κάθεται ακίνητη». Με άλλα λόγια, είναι πόσο αποτελεσματικά μια πρωτεΐνη διατηρεί ένα συγκεκριμένο σχήμα. Οι πρωτεΐνες μπορούν συνήθως να λάβουν μερικά σταθερά σχήματα. Οι βιοχημικοί συνεχίζουν να ενδιαφέρονται για τα σχήματα που καταλαμβάνουν οι πρωτεΐνες σε βιολογικές συνθήκες, όπως στο κύτταρο.
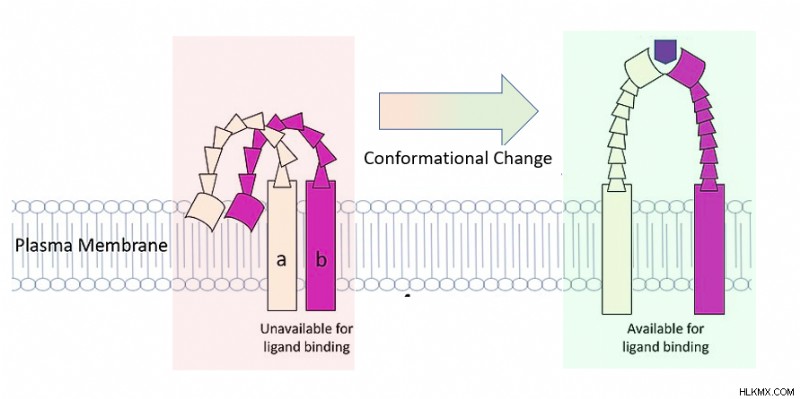
Δομή πρωτεΐνης
Γιατί είναι σημαντική η δομή της πρωτεΐνης;
Υπάρχουν δεκάδες χιλιάδες πρωτεΐνες που βρίσκονται στο ανθρώπινο σώμα. Όλοι έχουν διαφορετικούς ρόλους και πολλοί είναι απαραίτητοι για τη ζωή. Τι καθορίζει τους διαφορετικούς ρόλους τους; Το σχήμα μιας πρωτεΐνης είναι ένας σημαντικός παράγοντας στον τρόπο συμπεριφοράς της. Για παράδειγμα, η αιμοσφαιρίνη έχει ένα σχήμα που της επιτρέπει να προσλαμβάνει, να μεταφέρει και να απελευθερώνει οξυγόνο στο σώμα. Ωστόσο, η πρωτεΐνη Κερατίνη δεν μοιάζει σε τίποτα με την αιμοσφαιρίνη και δεν μπορεί να μεταφέρει οξυγόνο. Αντίθετα, σχηματίζει ισχυρές ίνες που αποτελούν τα μαλλιά και τα νύχια σας.
Τι καθορίζει τη δομή της πρωτεΐνης;
Οι πρωτεΐνες σχηματίζουν αλληλεπιδράσεις με τον εαυτό τους.
Τα αμινοξέα που συνθέτουν τις πρωτεΐνες έχουν χημικές ιδιότητες που τις βοηθούν να διατηρήσουν το σχήμα τους. Για παράδειγμα, στην πρωτογενή δομή μιας πρωτεΐνης, τα αμινοξέα συνδέονται μεταξύ τους μέσω ομοιοπολικών δεσμών για να σχηματίσουν μια μακριά και ανθεκτική αλυσίδα. Επιπλέον, αυτά τα αμινοξέα μπορούν να σχηματίσουν άλλους τύπους αλληλεπιδράσεων, όπως στον παρακάτω πίνακα, που τα βοηθούν να διατηρήσουν τα πιο πολύπλοκα συνολικά σχήματά τους.
Οι πρωτεϊνικές δομές βασίζονται σε ορισμένες θεμελιώδεις χημικές αλληλεπιδράσεις που λειτουργούν σαν κόλλα. Αυτά περιλαμβάνουν ιοντικούς δεσμούς, δεσμούς υδρογόνου, δυνάμεις Van de Waals και δισουλφιδικούς δεσμούς. Ο παρακάτω πίνακας είναι μια μεγάλη εισαγωγή σε αυτές τις δυνάμεις. Ωστόσο, δεν είναι μια πλήρης λίστα. Για παράδειγμα, τα αμινοξέα μπορούν να υποστούν μια πιο πολύπλοκη επαφή που ονομάζεται pi-stacking.
| Αλληλεπίδραση πρωτεϊνών | Επεξήγηση |
| Ιωνικοί δεσμοί | Σχηματίζονται ιοντικοί δεσμοί μεταξύ ατόμων ή μορίων με βάση το φορτίο. Οι πλευρικές αλυσίδες αμινοξέων ή οι ομάδες R, είτε έχουν θετικό φορτίο (όπως η λυσίνη), αρνητικό φορτίο (όπως το ασπαρτικό οξύ), είτε είναι ουδέτερες (όπως η γλυκίνη). Τα θετικά φορτισμένα αμινοξέα προσελκύουν αρνητικά φορτισμένα αμινοξέα. Γενικότερα, οι θετικές περιοχές σε μια πρωτεΐνη προσελκύουν αρνητικές περιοχές, σχηματίζοντας ισχυρούς ιοντικούς δεσμούς. |
| Δεσμοί υδρογόνου | Οι δεσμοί υδρογόνου είναι ισχυρές ηλεκτροστατικές αλληλεπιδράσεις που σχηματίζονται μεταξύ ενός ελαφρώς θετικού ατόμου υδρογόνου (που είναι συνδεδεμένο με Οξυγόνο, Άζωτο ή Φθόριο) και άλλου ατόμου O, N ή F. Αυτές είναι σημαντικές αλληλεπιδράσεις για πολλά βιολογικά μόρια. |
| Van der Waals | Van der Waals, ή η διασπορά του Λονδίνου, οι δυνάμεις είναι αδύναμες και εμφανίζονται σε πολύ κοντινή απόσταση. Αν και είναι η πιο αδύναμη αλληλεπίδραση εδώ, εξακολουθούν να παίζουν κρίσιμο ρόλο στη διατήρηση της δομής μιας πρωτεΐνης. |
| Δισουλφιδικοί δεσμοί | Οι δισουλφιδικοί δεσμοί είναι ομοιοπολικοί δεσμοί μεταξύ ατόμων θείου, που συνήθως βρίσκονται στο αμινοξύ Κυστεΐνη. Ονομάζονται επίσης δισουλφιδικοί δεσμοί ή γέφυρες, είναι ένας άλλος τρόπος για να σχηματιστούν συνδέσεις μεταξύ των αμινοξέων σε μια πρωτεΐνη. |
Αλληλεπιδράσεις με διαλύτες και άλλα μόρια.
Οι πρωτεΐνες χρησιμοποιούν αυτούς τους ίδιους τύπους αλληλεπιδράσεων για να σχηματίσουν χημικές σχέσεις με ό,τι υπάρχει γύρω τους. Για παράδειγμα, διασυνδέονται με διαφορετικούς διαλύτες. Επίσης διασυνδέονται με μόρια όλων των σχημάτων και μεγεθών, συμπεριλαμβανομένων άλλων πρωτεϊνών.
Στο εργαστήριο, οι πρωτεΐνες εκτίθενται σε διαλύτες όπως το νερό ή το αλκοόλ. Στη συνέχεια παίρνουν διαφορετικές δομές ανάλογα με τις ιδιότητες αυτών των διαλυτών. Οι πρωτεΐνες στο αλκοόλ συχνά μετουσιώνονται , που σημαίνει ότι χάνουν το μεγαλύτερο μέρος της δομής τους, αλλά διατηρούν την πρωταρχική τους αλληλουχία αμινοξέων. Οι πρωτεΐνες στο νερό παρουσιάζουν κάτι που ονομάζεται υδροφοβικό αποτέλεσμα .
Το υδροφοβικό φαινόμενο
Ένα από τα κύρια μόρια με τα οποία αλληλεπιδρούν οι πρωτεΐνες είναι το νερό. Οι πρωτεΐνες μπορεί να έχουν υδρόφιλες, «υδατοαγαπημένες» περιοχές καθώς και υδρόφοβες, «υδατοφοβικές» περιοχές. Όταν μια πρωτεΐνη βρίσκεται σε ένα περιβάλλον που είναι ως επί το πλείστον νερό, οι περιοχές που αγαπούν το νερό θα κανονίσουν να κοιτάζουν προς το νερό. Ωστόσο, οι περιοχές «που φοβούνται το νερό» θα αποφύγουν το νερό και θα αλληλεπιδράσουν με τον εαυτό τους. Αυτό ονομάζεται υδροφοβικό φαινόμενο. Στις περισσότερες πρωτεΐνες, αυτός είναι ο λόγος που τα υδρόφοβα αμινοξέα συγκεντρώνονται στον πυρήνα της πρωτεΐνης, ενώ οι υδρόφιλες περιοχές αποτελούν το εξωτερικό.
Πρωτεΐνες επίσης από αλληλεπιδράσεις με άλλες πρωτεΐνες. Ένα παράδειγμα είναι ένα ένζυμο που βρίσκεται σε ιούς που ονομάζεται αντίστροφη μεταγραφάση. Αποτελείται από δύο πρωτεΐνες σε ένα σύμπλεγμα που ονομάζεται διμερές (δι- που σημαίνει «δύο»). Οι δύο πρωτεΐνες στην ανάστροφη μεταγραφάση εξαρτώνται η μία από την άλλη για τη δομική τους σταθερότητα και τη λειτουργία τους.
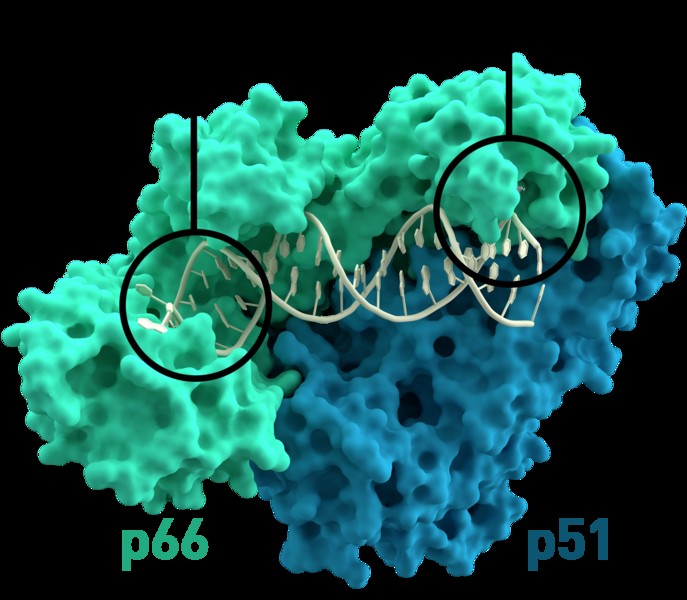
Σταθερότητα πρωτεΐνης
Η δομή και η σταθερότητα της πρωτεΐνης πάνε χέρι-χέρι. Οι αλληλεπιδράσεις που κρατούν τις πρωτεΐνες στο σχήμα τους, όπως οι δεσμοί υδρογόνου, μπορούν να επηρεαστούν από πολλούς παράγοντες. Αυτά περιλαμβάνουν διαλύτη, pH, αλατότητα (πόσο αλάτι υπάρχει), θερμοκρασία και παρουσία άλλων μορίων. Οι παρακάτω πίνακες παρουσιάζουν αυτούς τους παράγοντες.
Διαλύτης, pH και αλατότητα
| Συντελεστής | Επεξήγηση |
| Διαλύτης | Ο διαλύτης μπορεί να περιέχει μια ποικιλία ιδιοτήτων, οι οποίες επηρεάζουν τη δομή μιας πρωτεΐνης. Οι διαλύτες με αλκοόλη (-ΟΗ) μπορούν να σχηματίσουν και να διαρρήξουν τους δεσμούς υδρογόνου σε μια δομή πρωτεΐνης. Το νερό του διαλύτη προάγει το υδρόφοβο αποτέλεσμα. |
| pH | ΤοpH καθορίζει εάν ένα αμινοξύ δρα ως οξύ, βάση ή ουδέτερο είδος. Αυτό επηρεάζει το φορτίο του αμινοξέος (και το φορτίο της συνολικής πρωτεΐνης). Μια αλλαγή στο pH μπορεί να διαταράξει τις συνδέσεις που εξαρτώνται από το φορτίο, όπως οι ηλεκτροστατικές αλληλεπιδράσεις. Όταν τα αμινοξέα υφίστανται χημεία οξέος/βάσης, κερδίζουν ή χάνουν επίσης πρωτόνια, επομένως το pH μπορεί επίσης να διαταράξει τις συνδέσεις που εξαρτώνται από τα υδρογόνα, όπως οι δεσμοί υδρογόνου. |
| Αλατότητα | Η αλατότητα είναι ένα μέτρο του πόσο αλάτι υπάρχει στο διάλυμά σας και όχι μόνο το NaCl. Ένα χαμηλό επίπεδο αλατιού είναι συνήθως χρήσιμο για την αναδίπλωση των πρωτεϊνών, επειδή τα ιόντα του άλατος μπορούν να βοηθήσουν στη σταθεροποίηση των φορτίων στα αμινοξέα. Ωστόσο, τα υψηλά επίπεδα αλατιού μπορούν να διαταράξουν τις αλληλεπιδράσεις που χρειάζεται μια πρωτεΐνη για να αναδιπλωθεί. |
Θερμοκρασία και άλλα μόρια
| Συντελεστής | Επεξήγηση |
| Θερμοκρασία | Οι υψηλές θερμοκρασίες θα διαταράξουν επίσης τις αλληλεπιδράσεις που συγκρατούν μια δομή πρωτεΐνης. Οι πρωτεΐνες είναι συνήθως σταθερές σε χαμηλότερες θερμοκρασίες. Για παράδειγμα, αυτό αξιοποιείται σε μεθόδους απεικόνισης πρωτεϊνών όπως η Κρυογονική Εκλογική Μικροσκόπηση (Cryo-EM). |
| Μόρια | Αυτή η γενικότερη κατηγορία περιλαμβάνει πρωτεΐνες, μικρά μόρια σηματοδότησης, ακόμη και άλατα. Οι πρωτεΐνες μπορεί να βασίζονται σε άλλες πρωτεΐνες για τη σταθερότητά τους, όπως στην περίπτωση της αντίστροφης μεταγραφάσης. Μπορούν επίσης να βασίζονται σε άλλες πρωτεΐνες για αναδίπλωση, μεταφορά κυττάρων, σηματοδότηση και άλλες λειτουργίες. Αυτό συχνά συνοδεύεται από αλλαγή στο σχήμα της πρωτεΐνης. Τα μικρά μόρια σηματοδότησης μπορούν να επηρεάσουν τη χημεία σε μια μικρή περιοχή της πρωτεΐνης, γεγονός που μπορεί να οδηγήσει σε αλλαγές στη δομή της πρωτεΐνης με διάφορες επιπτώσεις. |
Περαιτέρω ανάγνωση
- Ριβονουκλεϊκό οξύ (RNA)
- Λιπίδια – Δομή, Λειτουργία και Παραδείγματα
- Δεοξυριβονουκλεϊκό οξύ (DNA)
- Επεξήγηση της μεταγραφής DNA
- Αντιγραφή DNA στη Βιολογία




